
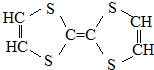
| A. | 它属于烃的衍生物 | B. | 所有的碳杂化方式相同 | ||
| C. | 属于高分子化合物 | D. | 它可以与氢气加成 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体中分散质微粒直径为1~100nm | |
| B. | 可用丁达尔现象判断胶体的制备是否成功 | |
| C. | 溶液一定是均一、稳定的混合物 | |
| D. | 长期放置后不会分层的液体,就是溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞.已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )
许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞.已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )| A. | Ca4TiO6 | B. | Ca4TiO3 | C. | Ca8TiO12 | D. | CaTiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题:
有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 盐酸 | 纯碱 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 硫酸 | 烧碱 | 食盐 | 氧化钙 | 一氧化碳 |
| C | 醋酸 | 苛性碱 | 小苏打 | 一氧化碳 | 二氧化硫 |
| D | 硫酸 | 苛性钾 | 苏打 | 氧化铜 | 三氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com