
| c2(C) |
| c2(A)?c(B) |
| c2(C) |
| c2(A)?c(B) |
| △c |
| t |
| c2(C) |
| c2(A)c(B) |
| c2(C) |
| c2(A)c(B) |
| n |
| V |
| 0.5mol |
| 2L |
| △c |
| t |
| 0.25mol/L |
| 1min |


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
下列反应中氧化剂与还原剂的物质的量之比为1:2,且电子转移数为0.1mol的是
A.已知:Cu+2Fe3+=2Fe2++Cu2+。将6.4gCu片放入0.1 mol/L的FeCl3溶液中充分反应
B. R2O82-离子在一定条件下可以把Mn2+氧化成MnO4-,而R2O82-离子变为RO42-,若得到的溶液中含MnO4-0.2mol
C. C1O2是一种杀菌、消毒、效率高、二次污染小的水处理剂。实验室制备原理:2KClO3
+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L
2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L
D.臭氧可使湿润的KI淀粉试纸变蓝,其原理为:O3+2KI+H2O=2KOH+I2+O2,测得1000mL溶液中的pH=13
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知:Cu+2Fe3+=2Fe2++Cu2+.将6.4gCu片放入0.1mol/L的FeCl3溶液中充分反应 | ||||
| B.R2O82-离子在一定条件下可以把Mn2+氧化成MnO4-,而R2O82-离子变为RO42-,若得到的溶液中含MnO4-0.2mol | ||||
C.C1O2是一种杀菌、消毒、效率高、二次污染小的水处理剂.实验室制备原理:2KClO3+H2C2O4+H2SO4
| ||||
| D.臭氧可使湿润的KI淀粉试纸变蓝,其原理为:O3+2KI+H2O=2KOH+I2+O2,测得1000mL溶液中的pH=13 |
查看答案和解析>>
科目:高中化学 来源:2011年山东省莱芜市凤城中学高考化学一模试卷(解析版) 题型:选择题
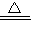 2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L
2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com