
【题目】有机物A(C10H20O2)具有兰花香味,可用做香皂、洗发香波的芳香赋予剂。

已知:①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯原子取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)。
a、取代反应 b、消去反应 c、加聚反应 d、氧化反应
(2)C、D、F分子所含的官能团的名称依次是
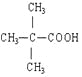
(3)写出E的结构简式:
(4)写出C→D的化学方程式:
(5)写出B→F的化学方程式:
【答案】(1) a、b、d ;
(2)醛基、羧基、碳碳双键
(3)
(4)2CH3(CH2)3CHO+O2![]() 2CH3(CH2)3COOH
2CH3(CH2)3COOH
(5)CH3(CH2)3CH2OH![]() CH3CH2CH2CH=CH2+H2O
CH3CH2CH2CH=CH2+H2O
【解析】试题分析:根据信息可知有机物A属于酯类分子式为C10H20O2,B、D、E碳原子数相同,且B为醇,D、E为酸。由B分子中没有支链知B为戊醇,结构简式为:CH3(CH2)3CH2OH;C为戊醛,结构简式为:CH3(CH2)3CHO ;D为戊酸,结构简式为:CH3(CH2)3COOH。由D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯原子取代,其一氯代物只有一种,可知E的结构简式为: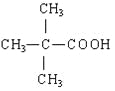 。B发生消去反应生成F可以使溴的四氯化碳溶液褪色,则F的结构简式为:CH3CH2CH2CH=CH2。据此可得下列结论:
。B发生消去反应生成F可以使溴的四氯化碳溶液褪色,则F的结构简式为:CH3CH2CH2CH=CH2。据此可得下列结论:
(1)B为CH3(CH2)3CH2OH,可以发生取代反应、消去反应、氧化反应。
故答案为:abd;
a、取代反应 b、消去反应 c、加聚反应 d、氧化反应
(2)C为CH3(CH2)3CHO,官能团是醛基、D为CH3(CH2)3COOH,官能团是羧基、F为CH3CH2CH2CH=CH2,分子所含的官能团的名称为碳碳双键。
故答案为:醛基、羧基、碳碳双键;
(3)根据上述分析可知,E的结构简式为: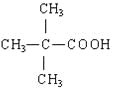 。
。
故答案为: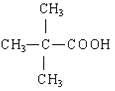 ;
;
(4)C→D的化学方程式为:2CH3(CH2)3CHO+O2![]() 2CH3(CH2)3COOH。
2CH3(CH2)3COOH。
故答案为:2CH3(CH2)3CHO+O2![]() 2CH3(CH2)3COOH;
2CH3(CH2)3COOH;
(5)写出B→F的化学方程式:CH3(CH2)3CH2OH![]() CH3CH2CH2CH=CH2+H2O。
CH3CH2CH2CH=CH2+H2O。
故答案为:CH3(CH2)3CH2OH![]() CH3CH2CH2CH=CH2+H2O。
CH3CH2CH2CH=CH2+H2O。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
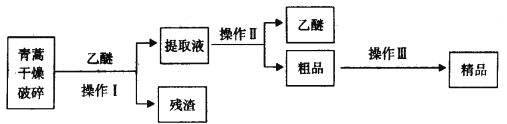
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、_________,操作Ⅱ的名称是_______________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
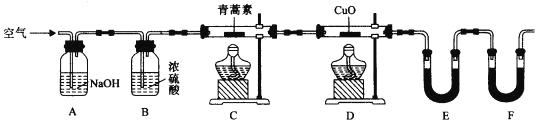
①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
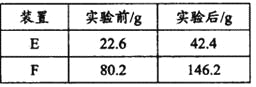
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
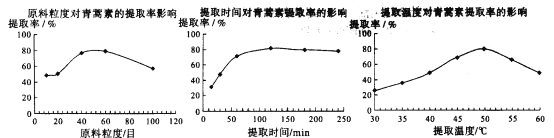
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________________,微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() );C为(
);C为(![]() ,
, ![]() ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
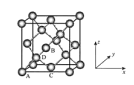
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a="565.76" pm,其密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温恒容下2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s)。2 min 时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
xC(g)+2D(s)。2 min 时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,A的转化率为________。
(2)x=________。
(3)下列各项可作为该反应达到平衡状态的标志的是________(填各项代号)
A.压强不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.A的消耗速率与B的消耗速率之比为2:1
Ⅱ.一定条件下,可逆反应A2(g)+B2(g) ![]() 2C(g)达到平衡时,各物质的平衡浓度分别为c(A2)=0.4mol·L—1;c(B2)=0.1mol·L—1;c(C)=1.6mol·L—1。
2C(g)达到平衡时,各物质的平衡浓度分别为c(A2)=0.4mol·L—1;c(B2)=0.1mol·L—1;c(C)=1.6mol·L—1。
(1)若反应开始时,反应容器中未加入B,10s后达到平衡,则10s内用C的浓度变化表示的化学反应速率为_____________。
(2)若A2、B2、C的初始浓度分别用a、b、c表示(mol·L—1),则:a、b应满足的关系是 。a的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Q、R、X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中Q原子外层电子数是内层电子数的两倍;化合物R2Z的晶体为离子晶体,Z原子核外的M层中有两对成对电子;X元素最外层电子数与最内层电子数相同;Y单质的晶体类型在同周期的单质中没有相同的;W元素所在族有三列,只有两个未成对的电子。请根据以上信息,回答下列问题:(答题时,Q、R、X、Y、Z、W用所对应的元素符号表示)
(1)W的外围电子(价电子)排布式是 。
(2)Q、R、X、Y的第一电离能由小到大的顺序为_ 。(用元素符号表示)
(3)QZ2分子的空间构型为 形。
(4)R的氯化物的熔点比Y的氯化物的熔点_ _(填高或低),理由是_ _ 。
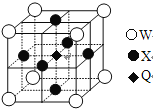
(5)据报道,只含Q、X、W三种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构如图,试写出该晶体的化学式_ 。晶体中每个X原子周围距离最近的W原子有__ _个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 molL-1,
2C(g)。若经2s后测得C的浓度为0.6 molL-1,
求(1)A表示的反应的平均速率?
(2)2 s时物质B的浓度?
(3)2 s时物质A的转化率?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题有三小题。
(1)已知N2,CO,H2O,NH3,CO2均为高中化学常见的分子,根据要求回答有关问题:
①根据等电子体原理,写出CO分子的结构式___________。
②试比较两分子中的键角大小:H2O___________NH3,(填“>”、“=”或“<” )
③基态N原子核外电子有 种不同的运动状态, B、C、N、O的第一电离能由大到小的顺序为 .
(2)科学家合成了Si60、N60, Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则28 g Si60分子中π键的数目为 。
(3)①立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________ 。
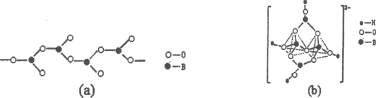
②在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________,图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。
(4) “嫦娥五号”探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质,回答下列问题:
①SeO3分子的立体构型为 .
②金属铜投入氨水或H2O2溶液中均无明显现象,但投入氨水与H2O2的混合溶液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子反应方程式为 .
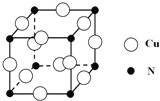
③某种铜合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子间的距离为![]() pm,则该晶体的密度为 (用含a的代数式表示,设NA为阿伏伽德罗常数的值).
pm,则该晶体的密度为 (用含a的代数式表示,设NA为阿伏伽德罗常数的值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A. 上述反应在较高温度下才能自发进行
B. 该反应的正反应活化能小于逆反应活化能
C. 该反应中,断裂化学键的总键能大于形成化学键的总键能
D. 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com