
| A、第三周期Ⅷ族,p区 |
| B、第三周期ⅤB族,ds区 |
| C、第四周期Ⅷ族,d区 |
| D、第四周期ⅤB族,f区 |


科目:高中化学 来源: 题型:
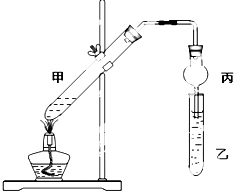 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别测定SO2、CO2饱和溶液的PH,可比较H2SO3、H2CO3二酸的强弱 |
| B、先滴入少量氯水,后滴入KSCN试液,可确定溶液中是否含Fe2+ |
| C、25℃若测知氨水与NH4Cl混合溶液的pH>7,可确定溶液中c(NH4+)>c(Cl-) |
| D、固体NH2COONH4(s)在密闭容器中存在:NH2COONH4(s)?2NH3(g)+CO2(g)△S>0,由此可确定反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行颜色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| C、Al、Fe、Cu对应的氧化物均能与酸反应生成盐和水,三种金属的氧化物均为碱性氧化物 |
| D、向某溶液中滴加氯水后,再滴加KSCN溶液后溶液显血红色,该溶液中不一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
| A、IA | B、ⅢA | C、ⅤA | D、ⅦA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL1mol/L Al2(SO4)3溶液中,Al3+数为0.2×6.02×1023 |
| B、0.1mol锌与100mL1mol/L 的稀盐酸充分反应,产生氢气的分子数为0.1×6.02×1023 |
| C、C60和C70的混合物共12g,其中所含碳原子数为6.02×1023 |
| D、1mol甲基(-CH3)与1mol氢氧根(OH-)所含电子数均为10×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+ 1s22s22p63s23p6 |
| B、F- 1s22s23p6 |
| C、S2- 1s22s22p63s23p4 |
| D、Ar 1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
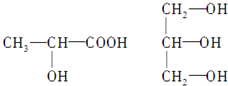
查看答案和解析>>
科目:高中化学 来源: 题型:
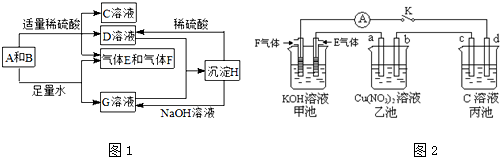
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com