
| A、④⑤ | B、①④ | C、②③⑤ | D、②⑤ |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |
| c(标注)×V(标准) |
| V(待测) |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、NH4+、NO3-、Al3+、I- |
| B、Na+、Al3+、K+、NO3- |
| C、Cu2+、K+、SO42-、Na+ |
| D、K+、SO42-、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
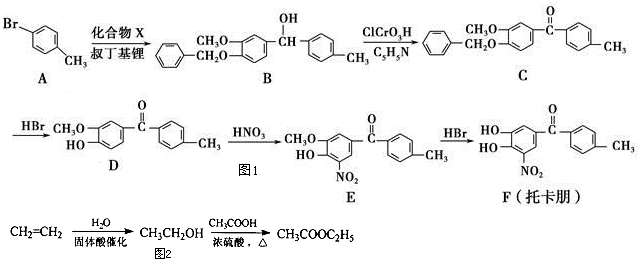
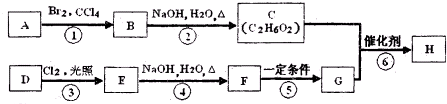
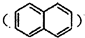 的衍生物,且取代基都在同一个苯环上;
的衍生物,且取代基都在同一个苯环上;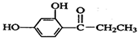 是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和
是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和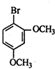 为原料(原流程图中的试剂及无机试剂任用)该化合物的合成路线流程图.合成路线流程图示例如图2:
为原料(原流程图中的试剂及无机试剂任用)该化合物的合成路线流程图.合成路线流程图示例如图2:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
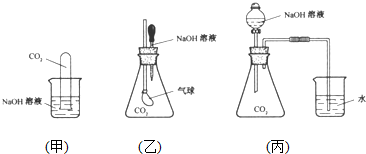
查看答案和解析>>
科目:高中化学 来源: 题型:
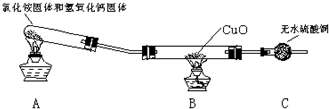
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com