
已知25℃时,Ksp(BaSO4)=1.1×10-10。则在5.0%的Na2SO4溶液中(假设溶液的密度为1 g·cm-3),Ba2+的最大浓度是( )
A.4.2×10-10 mol·L-1 B.8.4×10-10 mol·L-1
C.3.1×10-10 mol·L-1 D.5.8×10-10 mol·L-1
科目:高中化学 来源:2017届河南省高三上学期9月月考化学试卷(解析版) 题型:选择题
亚硫酸及其盐在工业上具有广泛的用途。下面来解释亚硫酸及其盐的有关性质的方程式正确的是
A.亚硫酸水溶液的pH<7:H2SO3 2H++SO32-
2H++SO32-
B.将亚硫酸滴入饱和Na2CO3溶液有气泡产生:2H++CO32-=H2O+CO2↑
C.Na2SO3溶液能使红色石蕊变蓝:SO32-+H2O=HSO3-+OH-
D.Na2SO3溶液中加入足量的酸化Ba(NO3)2溶液出现白色沉淀:
3SO32-+2NO3-+2H++3Ba2+=3BaSO4↓+2NO↑+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5 kJ/mol、-285.8 kJ/mol、-890.3 kJ/mol。则CH4(g) == C(s) + 2H2(g)的反应焓变(△H)为( )
A.-74.8 kJ/mol B.+74.8 kJ/mol C.-211kJ/mol D.+211kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上学期9月月考化学试卷(解析版) 题型:选择题
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以精铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,其电极反应是Cu-2e-===Cu2+
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上学期9月月考化学试卷(解析版) 题型:选择题
关于原电池的说法,正确的是( )
A.在正极上发生氧化反应 B.某电极上有氢气产生,则此电极为正极
C.在外电路电子流出的为正极 D.在负极上发生还原反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷(解析版) 题型:实验题
已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:
甲方案探究甲烷与氧化剂反应(如图1所示);
乙方案探究甲烷与氯气反应的条件(如图2所示)。
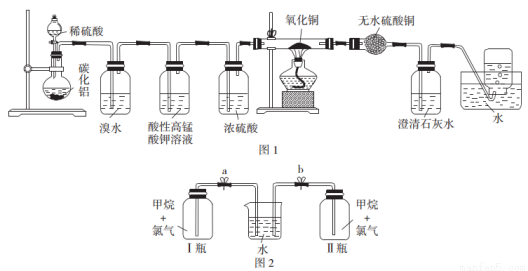
甲方案实验现象:溴水不褪色,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)的混合气体,I瓶放在光亮处,Ⅱ瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为____________________。
(2)实验甲中浓硫酸的作用是_______________,集气瓶中收集到的气体_________(填“能”或“不能”)直接排入空气中。
(3)下列对甲方案实验中的有关现象与结论的叙述都正确的是_________(填标号)。
A.酸性高锰酸钾溶液不褪色,结论是通常条件下甲烷不能与强氧化剂反应
B.硬质玻璃管里黑色粉末无颜色变化,结论是甲烷不与氧化铜反应
C.硬质玻璃管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(4)写出甲方案实验中硬质玻璃管里可能发生反应的化学方程式:________________(假设消耗甲烷与氧化铜的物质的量之比为2:7)。
(5)一段时间后,观察到图2装置中出现的实验现象是____________________;然后打开弹簧夹a、b,观察到的实验现象是______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次段考化学卷(解析版) 题型:实验题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和 。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L NaOH溶液对20.00 mL醋酸溶液进行滴定(酚酞作指示剂),几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(ml) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 mol/L。(保留小数点后四位)
(3)判断滴定终点的方法是 。
(4)下列操作中可能使所测醋酸溶液的浓度数值偏低的是 (填字母序号)。
A.碱式滴定管未用标准液润洗就直接注入标准液
B.滴定前盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.量取醋酸体积时,开始俯视读数,滴定结束时仰视读数
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 |
(5)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年北大附中河南分校高二上第一次月考化学卷(解析版) 题型:选择题
在298 K时下述反应的有关数据:
C(s)+1/2O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
则C(s)+C O2(g)===2CO(g)的ΔH为( )
O2(g)===2CO(g)的ΔH为( )
A.+283.5 kJ·mol-1 B.+172.5 kJ·mol-1
C.-172.5 kJ·mol-1 D.-504 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com