
下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是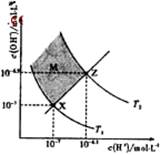
| A.两条曲线间任意点均有c(H+)×c(OH-)=Kw |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
向20 mL盐酸和硫酸的混合酸溶液中逐滴加入0.1 mol ·L-1的氢氧化钡溶液,生成沉淀的质量和溶液的pH与加入的氢氧化钡溶液体积的关系图如下图。试回答:
![]()
(1)起始时,混酸中硫酸的物质的量浓度为多少?
(2)起始时,混酸中盐酸的物质的量浓度为多少?
(3)B点表示的沉淀质量是多少?
(4)A点表示溶液中c(H+)为多少?pH是多少?
(5)C点表示溶液中c(H+)为多少?pH是多少?
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省沈阳市高二上教学质量监测化学试卷(解析版) 题型:填空题
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是 (填“图1”或“图2”)

(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系

①M区域内(阴影部分)任意点c(H+)______c(OH-)(填“大于”、“小于”或“等于”)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液的体积比为 。(混合后溶液体积的变化忽略不计)
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(大纲卷解析版) 题型:选择题
下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
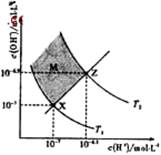
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com