
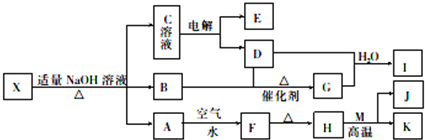
分析 F是一种红褐色沉淀,则F为Fe(OH)3,可推知A为Fe(OH)2,则H为,M、K是常见的金属单质,结合H与M反应的条件可知,H为Fe2O3,M为Al,K为Fe,J为Al2O3,X与氢氧化钠反应生成的B是一种有刺激性气味的气体,则要推知B为NH3,向C溶液中加入 BaCl2溶液,生成不溶于稀盐酸的白色沉淀,则C中有Na2SO4,电解后可产生氧气和氢气,氧气能氧化氨气,所以D为O2,E为H2,氨气被氧气氧化成G为NO,所I为HNO3,结构A、B、C的成分可知X中有亚铁离子、铵根离子、硫酸根离子,X不带结晶水,则X为(NH4)2Fe(SO4)2,据此答题.
解答 解:F是一种红褐色沉淀,则F为Fe(OH)3,可推知A为Fe(OH)2,则H为,M、K是常见的金属单质,结合H与M反应的条件可知,H为Fe2O3,M为Al,K为Fe,J为Al2O3,X与氢氧化钠反应生成的B是一种有刺激性气味的气体,则要推知B为NH3,向C溶液中加入 BaCl2溶液,生成不溶于稀盐酸的白色沉淀,则C中有Na2SO4,电解后可产生氧气和氢气,氧气能氧化氨气,所以D为O2,E为H2,氨气被氧气氧化成G为NO,所I为HNO3,结构A、B、C的成分可知X中有亚铁离子、铵根离子、硫酸根离子,X不带结晶水,则X为(NH4)2Fe(SO4)2,
(1)根据上面的分析可知,X的化学式为(NH4)2Fe(SO4)2,
故答案为:(NH4)2Fe(SO4)2;
(2)根据反应4NO+3O2+2H2O=4HNO3可知,反应时NO和O2的物质的之比为4:3,
故答案为:4:3;
(3)足量的铁与硝酸的稀溶液反应的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)I与NaOH溶液恰好完全反应可生成一种盐为NaNO3,将该盐的水溶液蒸干灼烧可得到NaNO2,
故答案为:NaNO2;
(5)X为(NH4)2Fe(SO4)2,在0.02mol•L-1的X溶液中,由于亚铁离子和铵根离子都能水解,所以各种离子的浓度由大到小的顺序为 c(SO42-)>((NH4+)>c(Fe2+)>((H+)>(OH-),
故答案为:c(SO42-)>((NH4+)>c(Fe2+)>((H+)>(OH-).
点评 本题考查了无机物的推断,涉及Fe与N元素化合物转化、电解、常用化学用语、铝热反应等,正确推断物质是解本题关键,F是一种红褐色沉淀为突破口,采用正逆相结合的方法推断,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 36.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
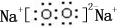 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
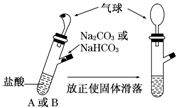 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )| A. | A装置的气球膨胀速率大 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na +、Cl - 的物质的量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
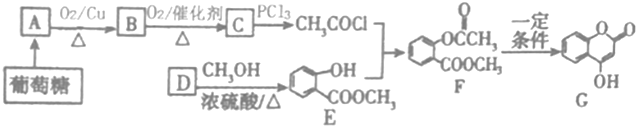
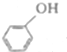 +NaOH→
+NaOH→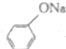 +H2O
+H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H8+x-2yR | B. | H8-x+2yR | C. | Hx-2yR | D. | H2y-xR |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com