
����Ŀ��(1)��ĭ������װ��Al2(SO4)3��Һ��NaHCO3��Һ�����ݼ���д��ʹ��ʱ������Ӧ�����ӷ���ʽ ________________________��
(2)д�����ܵ���ʵ��ܶȻ�����ʽ��Mg(OH)2��____________����Mg(OH)2����Һ�м���MgCl2���壬ƽ��________�ƶ�(��������������������������)��Ksp________(��������������С������������)��
(3)1 g����̿��ˮ������Ӧ����CO�����H2���壬������a kJ�������˷�Ӧ���Ȼ�ѧ����ʽΪ____��
���𰸡�Al3����3HCO![]() =Al(OH)3����3CO2�� Ksp��c(Mg2+)�� c(OH-)2 ���� ���� C(s)��H2O(g)=CO(g)��H2(g) ��H��+12a kJ��mol��1
=Al(OH)3����3CO2�� Ksp��c(Mg2+)�� c(OH-)2 ���� ���� C(s)��H2O(g)=CO(g)��H2(g) ��H��+12a kJ��mol��1
��������
(1)��������̼�����Ʒ���˫ˮ�ⷴӦ�������������Ͷ�����̼��
(2)Ksp=c(Mg2+)c(OH-)2��þ��������������þ�ܽ⣬�¶Ȳ����ܶȻ��������䣻
(3)1g̼�����ʵ���=![]() ��1g̼��ˮ������Ӧ����CO��H2��������akJ������1mol̼��Ӧ��Ҫ����12akJ������
��1g̼��ˮ������Ӧ����CO��H2��������akJ������1mol̼��Ӧ��Ҫ����12akJ������
(1)��������̼�����Ʒ���˫ˮ�ⷴӦ�������������Ͷ�����̼�����ӷ���ʽΪ��Al3����3HCO![]() =Al(OH)3����3CO2����
=Al(OH)3����3CO2����
(2)Ksp=c(Mg2+)c(OH-)2��Mg(OH)2����Һ�м���MgCl2���壬þ����Ũ����������������þ�ܽ⣬ƽ�����淴Ӧ�����ƶ����¶Ȳ��䣬�ܶȻ��������䣻
(3)1g̼�����ʵ���=![]() =
=![]() mol��1g̼��ˮ������Ӧ����CO��H2��������akJ������1mol̼��Ӧ��Ҫ����12akJ���������Ȼ�ѧ����ʽΪ��C(s)��H2O(g)=CO(g)��H2(g) ��H��+12a kJ��mol��1��
mol��1g̼��ˮ������Ӧ����CO��H2��������akJ������1mol̼��Ӧ��Ҫ����12akJ���������Ȼ�ѧ����ʽΪ��C(s)��H2O(g)=CO(g)��H2(g) ��H��+12a kJ��mol��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(���ӻ�����)������18�����ӣ�
���� | A�� | B2�� | C | D | E | F |
����ص� | �������� | �����˫�˷��� | ���ʣ�˫�˷��� | ��������˷��� | ������ĺ˷��� | |
��ش��������⣺
(1)A��Ԫ�ط�����____________��B2���Ľṹʾ��ͼ��________��
(2)C��D��ϣ�������Ӧ�Ļ�ѧ����ʽΪ_____________________________________��
(3)E�ĵ���ʽ��________��F��ˮ��Һ��������������F�Ļ�ѧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ�����ճ�����ı���Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϡ�
��1����ʳ���г���������K����Ca2����Mg2����Fe3����SO42-���������ӣ�ʵ�����ᴿNaCl���������£�
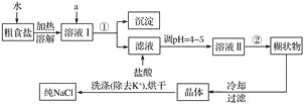
�ṩ���Լ�������Na2CO3��Һ������K2CO3��Һ��NaOH��Һ��BaCl2��Һ��Ba(NO3)2��Һ��75%�Ҵ������Ȼ�̼
������ȥ��Һ���е�Ca2����Mg2����Fe3����SO42-��ѡ��a���������Լ������μ�˳������Ϊ________(ֻ�ѧʽ)��
�ڷ�������������õ��IJ���������____________��
��ϴ�ӳ�ȥNaCl������渽��������KCl��ѡ�õ��Լ�Ϊ________��
��2�����ᴿ��NaCl����450 mL 4.00 mol��L��1NaCl��Һ������������ҩ�ס��ձ������������________(����������)��
��3����ʵ���ж���õ������������������������ֱ���______________��______________��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼʵ������У���ȷ����(����)
A.ȡ��ҩƷ B.���������̼
B.���������̼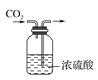
C.�ⶨij��Һ��pH 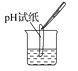 D.�μ�Һ��
D.�μ�Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƿ����������ೱ��Ӧ�������ȡ���֪���������ƣ�Ϊ��ɫ��ɫ�ᾧ��ĩ��������ˮ���������Ҵ������ѵ��л��ܼ��������¸���Ʒ���ȶ���������ϡ�����ɹ������⡣ijС��ͬѧ̽���������Ƶ��Ʒ������ʣ�
(1)�ס�����λͬѧ��ƵĹ�������ʵ�����Ʒ����£����в��ʽϵ͵���______(��A��B)
����A Ca (OH)2 (s) + H2O2 CaO2 (s) + 2H2O
����B CaCl2 (s) + H2O2 CaO2 (s) + 2HCl
����A���ò�Ʒ�д��Ȳ��ߣ�����������Ҫ�� ___________(�ѧʽ)
����������ȶ����������ַ���������5�����½���ʵ�飬ԭ�������______________��
(2)��ͬѧ��ΪCO2��SO2��������Ƶķ�Ӧԭ����ͬ����ͬѧ��ΪSO2���н�ǿ�Ļ�ԭ�ԣ���CO2û�У��ʶ���Ӧԭ������ͬ���������������ʵ��װ�ã�ͨ������װ��E��������������жϷ�Ӧ�����
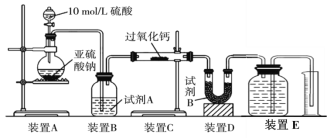
���Լ�B��������____________________��
����ʵ����SO2����������������Ƴ�ַ�Ӧ��ȡ��Ӧ��Ĺ������̽��������֤����������SO2��Ӧ���������SO2δ����������Ӧ�Ļ�ѧ����ʽΪ��______________________________��
��װ��E���ռ������������ΪV L(�ѻ���ɱ�״����)����SO2��ȫ����������V =______��
(3)ij�������õ�ʯ��(��Ҫ�ɷ�Ϊ��������)�����������Ƶ������������£�
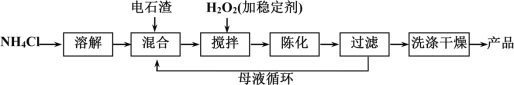
�����������Ʊ���������(CaO2��8H2O)�����貽���Ļ�ѧ����ʽ��______________��
��ijС����õ�������ȷ���¶ȡ�H2O2Ũ�ȶԲ��ʵ�Ӱ�죬������£���ʵ������Ӧѡ�����������Ϊ__________��
H2O2 % | 30% | 25% | 20% | 15% | 10% | 5% | ||||||
���� | 60.40 | 62.42 | 64.54 | 63.20 | 63.10 | 62.40 | ||||||
�¶�(��) | 50 | 40 | 30 | 20 | 10 | 0 | ||||||
���� | 43.24 | 52.80 | 64.54 | 63.80 | 60.45 | 52.40 | ||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������漰��ѧѧ�ƹ۵���й�˵����ȷ����![]()
A. ���ۣ���������������ԭ�Ӻ���ԭ�ӹ��ɵ�
B. ת���ۣ������¶ȿ��Խ��������������Һת��Ϊ����
C. �غ�ۣ�1gþ��1gϡ�����ַ�Ӧ�����õ���Һ����Ϊ2g
D. �ṹ�ۣ����ʯ��ʯī���ڽṹ��̼ԭ�ӵ����з�ʽ��ͬ�����ʴ����Žϴ�IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ھ����˵������ȷ���ǣ� ��
A.���御���ܲ�ȡ���ܶѻ���ʽ����ʹ���ñȽ��ȶ�
B.�����Ǿ���ṹ�Ļ�����Ԫ�������ڲ�������һ���������������ظ�����
C.12g���ʯ�����12gʯī���庬�е�C��C����Ŀ֮��Ϊ4��3
D.��ͬ����������ͼ�������Ļ�ѧ����Ŀ����8NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ�������й�������ȷ����(����)
A.0.1 mol C2H6O�����к���C��H����Ϊ0.5NA
B.0.1 mol Cl2��0.1 mol HI��ַ�Ӧ�����������Ϊ0.2NA
C.CO2ͨ��Na2O2ʹ������2.8 g����Ӧ��ת�Ƶ�����Ϊ0.2NA
D.3.0 g��ȩ(HCHO)������Ļ�����к��е�ԭ������Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦN2+3H2��2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�� �� ��
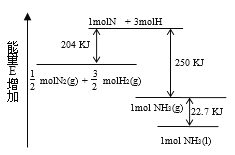
A.![]() N2(g)+
N2(g)+![]() H2(g)�� NH3(l) ��H=-46kJ/mol
H2(g)�� NH3(l) ��H=-46kJ/mol
B.![]() N2(g)+
N2(g)+ ![]() H2(g)�� NH3(g) ��H=-454kJ/mol
H2(g)�� NH3(g) ��H=-454kJ/mol
C.N2(g)+3H2(g)��2NH3(g) ��H=-92kJ/mol
D.N2(g)+3H2(g)��2NH3(1) ��H= +431.3kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com