
| A. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 | |
| B. | 原子吸收光谱可用于测定物质中的金属元素,红外光谱可用于测定化合物的官能团 | |
| C. | 阴极射线、a粒子散射实验及布朗运动发现都对原子模型建立做出了贡献 | |
| D. | 常温常压下2g氦气含有的质子数与31g白磷中含有的P-P键数不一样多 |
分析 A.蛋白质的二级结构和DNA双螺旋结构中有氢键;
B.用红外光谱仪可以确定物质中是否存在某些有机原子基团,用原子吸收光谱仪可以确定物质中含有哪些金属元素;
C.布朗运动是悬浮微粒的无规则运动;
D.2g氦气含有的质子为$\frac{2g}{4g/mol}$×2=1mol,31g白磷中含有的P-P键为$\frac{31g}{4×31g/mol}$×6=1.5mol.
解答 解:A.氢键对维持生物大分子的空间构型和生理活性具有重要意义,所以氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用,故A正确;
B.用红外光谱仪可以确定物质中是否存在某些有机原子基团,用原子吸收光谱仪可以确定物质中含有哪些金属元素,故B正确;
C.布朗运动是悬浮微粒的无规则运动,与原子结构模型的建立无关,故C错误;
D.2g氦气含有的质子为$\frac{2g}{4g/mol}$×2=1mol,白磷是正四面体型结构,分子中含有6个P-P共价键,31g白磷中含有的P-P键为$\frac{31g}{4×31g/mol}$×6=1.5mol,物质的量不同则个数不同,故D正确;
故选C.
点评 本题考查了氢键、物理分析技术和物质的量为中心的计算等,难度不大,D选项注意氦气是单原子分子以及白磷的空间构性.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2H2O 反应类型为:酯化反应.
+2H2O 反应类型为:酯化反应.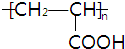 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性;Na+<Mg2+<Al3+ | B. | 半径:C1->S2->F- | ||
| C. | 稳定性:HF>HCl>HBr>HI | D. | 酸性:HClO4>H2SO4>H2CO3>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | 全部 | C. | ①③④⑤⑥ | D. | ①③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①④ | C. | ②③ | D. | ②③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com