
| A. | 常见铅蓄电池放电时,负极质量减轻,正极质量增加 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 常温下,pH=5的盐酸稀释1000倍后,溶液的pH=8 | |
| D. | 水的离子积随温度升高而增大,说明水的电离是吸热反应 |
分析 A.铅蓄电池放电时,负极反应为:Pb-2e-+SO42-=PbSO4,正极的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
B.电解精炼粗铜时,粗铜作阳极、纯铜作阴极;
C.酸无论如何稀释都不能变为中性或碱性;
D.水的离子积随温度升高而增大,说明升高温度促进水电离.
解答 解:A.铅蓄电池放电时,负极反应为:Pb-2e-+SO42-=PbSO4,正极的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,所以正负极质量都增大,故A错误;
B.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解质溶液为可溶性铜盐溶液,故B错误;
C.酸无论如何稀释都不能变为中性或碱性,接近中性时要考虑水的电离,所以常温下,pH=5的盐酸稀释1000倍后,溶液的pH接近7但小于7,故C错误;
D.水的离子积随温度升高而增大,说明升高温度促进水电离,则水的电离是吸热反应,故D正确;
故选D.
点评 本题考查原电池和电解池原理及水的电离等知识点,侧重考查基本原理,明确原电池和电解池各个电极上发生的反应及水电离特点即可解答,易错选项是C,注意:酸或碱在稀释过程中接近中性时要考虑水的电离,为易错题.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
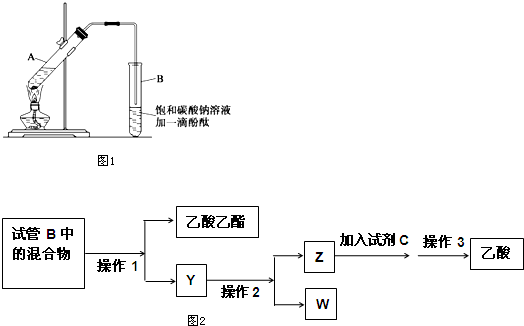
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O<N | Cl<F | NaCl<CaO | HF>HCl |
| 共价键 | H-Cl | O=O | H-O | Cl-Cl |
| 键能/kJ•mol-1 | 431 | 498 | 463 | 243 |
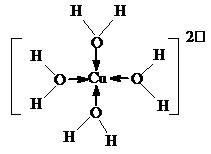 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯净物C4H8的核磁共振氢谱峰最多为4 | |
| B. | 化学式为C8H8的有机物,一定能使酸性高锰酸钾溶液褪色 | |
| C. | 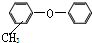 的同分异构体中,可以有醇、酚类物质 的同分异构体中,可以有醇、酚类物质 | |
| D. | 1 mol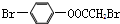 最多能与2 mol NaOH反应 最多能与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
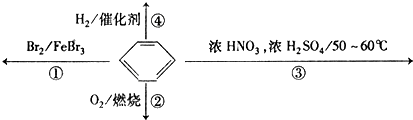
| A. | 反应①为取代反应,有机产物的密度比水小 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟 | |
| C. | 反应③为取代反应,有机产物是一种烃 | |
| D. | 反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳酸双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com