
| A. | 不同元素的原子发生跃迁时,会释放不同的光 | |
| B. | 第一电离能与电负性的数值都是以气态中性基态原子为研究对象测得到 | |
| C. | 分子中的原子有固定的空间位置,组成完全相同的分子,由于原子位置的不同会表现出不同的性质 | |
| D. | 两个相同的原子的任意未成对电子的电子云在两个原子核间重叠,形成非极性共价键 |
分析 A.发生跃迁时,有的吸收能量,有的释放能量;
B.第一电离能数值是以气态中性基态原子为研究对象测得到;
C.分子是保存物质化学性质的最小微粒;
D.两个相同的原子,为同种元素的原子,形成非极性共价键.
解答 解:A.发生跃迁时,有的吸收能量,有的释放能量,则不同元素的原子发生跃迁时,会释放或吸收不同的光,故A错误;
B.第一电离能数值是以气态中性基态原子为研究对象测得到,而电负性衡量元素的非金属性,故B错误;
C.分子是保存物质化学性质的最小微粒,则相同的分子,化学性质相同,与原子的位置无关,故C错误;
D.两个相同的原子,为同种元素的原子,则两个相同的原子的任意未成对电子的电子云在两个原子核间重叠,形成非极性共价键,故D正确;
故选D.
点评 本题考查原子结构与性质、化学键等,为高频考点,把握元素的性质、化学键的形成为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备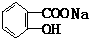
 与NaOH的醇溶液共热制备CH3-CH=CH2.
与NaOH的醇溶液共热制备CH3-CH=CH2.| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
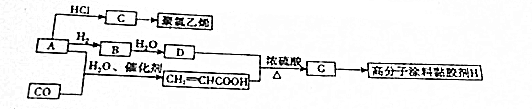
 ,A→C的反应类型:加成反应.
,A→C的反应类型:加成反应.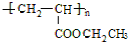 ,写出D的同分异构体的结构简式:CH3OCH3.
,写出D的同分异构体的结构简式:CH3OCH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
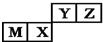
| A. | 原子半径:M>X>Y>Z | |
| B. | M的氯化物是弱电解质 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | 简单离子的半径M小于Z |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,5L CH4气体与5L NH3气体的原子个数之比为5:4 | |
| B. | 常温常压下,11.2L O3中所含氧原子个数大于1.5NA | |
| C. | 同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的密度 | |
| D. | 同温、同压下,等质量的一氧化碳和二氧化碳的密度比为11:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
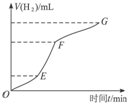 某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如图.请回答:
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (SCN)2+2Br-→Br2+2SCN- | |
| B. | (SCN)2+H2S→2H++2SCN-+S↓ | |
| C. | 4H++2SCN-+MnO2 $\stackrel{△}{→}$Mn2++(SCN)2↑+2H2O | |
| D. | (SCN)2+2I-→2SCN-+I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com