
分析 ①②由方程式可知,Fe元素化合价由0价变为+2价,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,H+被还原生成H2,则电解质溶液为稀盐酸或稀硫酸;
③根据氢气和转移电子之间的关系式计算氢气体积.
解答 解:①由方程式可知,Fe元素化合价由0价变为+2价,则负极应为Fe,发生氧化反应生成Fe2+,电极反应式为Fe-2e-═Fe2+,电子从负极沿导线流向正极,所以负极上电子流出,
故答案为:Fe;Fe-2e-═Fe2+;流出;
②正极上氢离子得电子发生还原反应,电极反应式为2H++2e-═H2↑,故答案为:2H++2e-═H2↑;还原反应;
③根据2H++2e-═H2↑知,生成22.4L氢气需要转移2×6.02×1023个e-,电子,则转移6.02×1022个e-生成氢气体积=$\frac{6.02×1{0}^{22}}{2×6.02×1{0}^{23}}$=1.12L,
故答案为:1.12L.
点评 本题考查原电池设计,明确原电池原理是解本题关键,知道从化合价变化确定正负极、电解质溶液,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
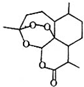 屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )
屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素是芳香族化合物 | ||
| C. | 青蒿素可以发生水解反应 | D. | 青蒿素不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
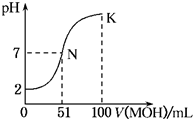 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 137表示质量数 | B. | 137表示质子数 | ||
| C. | 该原子质子数大于中子数 | D. | 55表示中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 脱氧过程是吸热反映,可降低温度,延长糕点保质期 | |
| B. | 脱氧过程中铁作原电池负极,电极反应为:Fe-3e-→Fe3+ | |
| C. | 脱氧过程中热能转化为生成物的内部能量 | |
| D. | 标准状况能吸收氧气336mL,理论上最少要含有1.12g铁粉的脱氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物中一定含有共价键 | |
| B. | 含有离子键的化合物一定就是离子化合物 | |
| C. | 双原子单质分子中的共价键一定是非极性键 | |
| D. | 原子最外层电子数大于4的元素一定是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
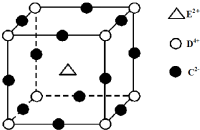 周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.
周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.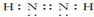 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com