
元素周期表的一部分,按要求完成各小题.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)化学性质最不活泼的元素 ,(填元素编号),非金属性最强的元素是 .金属性最强的单质与水反应的离子方程式为
(2)①③⑤三种元素的最高价氧化物水化物中,碱性最强的 .(填元素编号)
(3)①③⑤三种元素的原子半径由大到小的顺序为 .(填元素编号)
(4)某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素名称为 .向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,反应离子方程式为 .
(5)铜与元素周期表中26号元素的单质作电极材料,三氯化铁溶液为电解质溶液形成原电池,则负极材料为 .正极反应方程式为 ,该原电池总反应离子方程式为 .
考点:
位置结构性质的相互关系应用.
分析:
由元素在周期表中位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑪为F.
(1)稀有气体化学性质最不活泼;同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中K的金属性最强,与水反应生成氢氧化钾与氢气;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)同周期自左而右原子半径减小;
(4)氢氧化铝能与强酸、强碱反应生成盐与水,氯化铝溶液中缓缓滴加NaOH至过量,先生成氢氧化铝沉淀,后氢氧化铝与氢氧化钠反应而溶解;
(5)26号元素为Fe,三氯化铁溶液为电解质溶液形成原电池,原电池负极材料为叫活泼金属,正极发生还原反应,负极发生氧化反应,以此解答.
解答:
解:由元素在周期表中位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑪为F.
(1)稀有气体Ar的化学性质最不活泼;同周期自左而右金属性减弱,非金属性增强,同主族自上而下金属性增强,非金属性减弱,故上述元素中非金属性最强的为F,K的金属性最强,与水反应生成氢氧化钾与氢气,反应离子方程式为2K+2H2O=2K++2OH﹣+O2↑,故答案为:⑩;⑪; 2K+2H2O═2K++2OH﹣+H2↑;
(2)金属性Na>Mg>Al,故碱性NaOH>Mg(OH)2>Al(OH)3,故答案为:①;
(3)同周期自左而右原子半径减小,故原子半径为Na>Mg>Al,故答案为:①③⑤;
(4)氢氧化铝能与强酸、强碱反应生成盐与水,氯化铝溶液中缓缓滴加NaOH至过量,先生成氢氧化铝沉淀,后氢氧化铝与氢氧化钠反应而溶解,反应的离子方程式为Al3++4OH﹣=AlO2﹣+2H2O,故答案为:铝 Al3++4OH﹣=AlO2﹣+2H2O;
(5)26号元素为Fe,三氯化铁溶液为电解质溶液形成原电池,原电池负极材料为叫活泼金属,正极发生还原反应,电极方程式为Fe3++e﹣=Fe2+,负极为铁被氧化,该原电池总反应离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:铁;Fe3++e﹣=Fe2+,Fe+2Fe3+=3Fe2+.
点评:
本题考查元素周期表与元素周期律,为高频考点,侧重于学生的分析能力的考查,难度不大,注意对元素周期表的整体把握,理解掌握同周期、同主族元素化合物性质递变规律.


科目:高中化学 来源: 题型:
合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有________性。
②________(填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是________(填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入________(填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是________(填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图,已知断裂1molN﹣N吸收167kJ热量,生成1mol N≡N放出942kJ热量.根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )
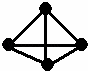
|
| A. | ﹣441kJ•mol﹣1 | B. | +441kJ•mol﹣1 | C. | ﹣882kJ•mol﹣1 | D. | +882kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 |
|
| B. | 同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐增强 |
|
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
|
| D. | 原子最外层电子数大于4的元素一定是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)X在周期表中的位置是 .
(2)化合物Y2X2的电子式为 ;它含有的化学键类型有 (填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为 .
(4)化合物A2X和A2S中,沸点较高的是 (填化学式)
(5)常温常压下,由A,B,X三种元素组成一种常见的液态燃料甲.现有2.3克甲与4.8克的X单质恰好完全反应,生成标准状况下2.24L的BX2气体和2.7克的A2X液体,同时放出68.35KJ的热量,该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,可逆反应3X(g)+Y(g)⇌2Z(g)达到限度的标志是( )
|
| A. | 单位时间内生成3nmolX,同时消耗nmolY |
|
| B. | X、Y、Z的浓度相等 |
|
| C. | X的生成速率与Z的生成速率相等 |
|
| D. | X、Y、Z的分子个数比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Cl有两种天然同位素35Cl、37Cl,Cl的相对原子质量为35.5,Na只有一种原子23Na,求10吨纯度为90%的食盐(杂质中不含Na、Cl)样品中含37Cl多少吨,含Na35Cl多少吨.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com