
| A、离子半径:Mg2+>Na+>F- | B、熔点:K>Na>Li | C、酸性: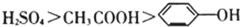 | D、热稳定性:HBr>HCl>HF |


科目:高中化学 来源: 题型:
(08泉州五中模拟)下列各项因果关系中正确的是( )
A.氨的沸点高于氯化氢,是因为分子间会形成氢键的氢化物其沸点一定高于不形成氢键的氢化物
B.同温下,强电解质溶液的导电能力一定大于弱电解质,是因为强电解质在溶液中完全电离
C.常温下,可用铁制容器装运浓硝酸,是因为常温下铁与浓硝酸不反应
D.苯酚钠溶液通入CO2后不生成Na2CO3,是因为HCO3-电离H+的能力弱于苯酚查看答案和解析>>
科目:高中化学 来源:2009-2010学年山东省青岛九中高二(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源: 题型:
(08泉州五中模拟)下列各项因果关系中正确的是( )
A.氨的沸点高于氯化氢,是因为分子间会形成氢键的氢化物其沸点一定高于不形成氢键的氢化物
B.同温下,强电解质溶液的导电能力一定大于弱电解质,是因为强电解质在溶液中完全电离
C.常温下,可用铁制容器装运浓硝酸,是因为常温下铁与浓硝酸不反应
D.苯酚钠溶液通入CO2后不生成Na2CO3,是因为HCO3-电离H+的能力弱于苯酚查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com