
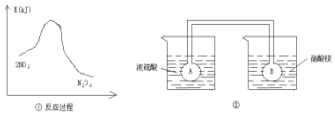
 利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体.B瓶中的气体颜色比A瓶中的浅(填“深”或“浅”),其原因是2NO?N2O4△H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅.
利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体.B瓶中的气体颜色比A瓶中的浅(填“深”或“浅”),其原因是2NO?N2O4△H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅. 分析 由图①可知,二氧化氮转化为四氧化二氮的反应为放热反应,图②中,浓硫酸溶解于水温度升高,而硝酸铵溶解于水溶液温度降低,则右侧烧杯的温度低于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,以此解答该题.
解答 解:由图①可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,而图②中,因浓硫酸溶解于水溶液温度升高,硝酸铵溶解于水溶液温度降低,左侧烧杯的温度高于右侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色变浅,
故答案为:浅;2NO?N2O4△H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅.
点评 本题考查化学反应与能量变化以及化学平衡移动,为高频考点,侧重对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的溴(苯) | |
| B. | MgCl2酸性溶液中少量的FeCl3(Mg(OH)2) | |
| C. | 硝基苯中的苯(硝酸) | |
| D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+Mg2+ CO32-Cl- | B. | Fe3+Cl- Na+H+ | ||
| C. | H+ Ag+ NO3- NH4+ | D. | CO32-H+Na+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}S$ | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | H2O2的电子式: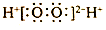 | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-=SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S=PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com