
(1)简述对角线元素化学性质之所以相似的原因(以Li、Mg为例)。
(2)锂在空气中燃烧时,除生成________外,也能生成微量的________。
(3)铍的最高价氧化物对应水化物是两性氢氧化物,证明这一结论的有关反应的离子方程式为______________________。
解析:在复习元素周期律的基础上来考虑本题。元素的化学性质如金属性、非金属性强弱与原子结构有关。原子半径增大,金属性增强,失电子能力增强,最高价氧化物对应水化物的碱性增强;原子半径减小,非金属性增强,得电子能力增强,气态氢化物的稳定性增强。Li、Mg这两种元素的原子半径都大于Be,小于Na,由于原子半径相近,所以在化学反应中失电子能力相近,使它们在化学性质上具有相似性。
答案:(1)这可以从它们的原子半径来考虑:因为这两种元素的原子半径都大于Be,小于Na,由于原子半径相近,所以在化学反应中失电子能力相近,使它们在化学性质上具有相似性。
(2)Li2O Li3N
(3)Be(OH)2+2H+![]() Be2++2H2O,Be(OH)2+2OH-
Be2++2H2O,Be(OH)2+2OH-![]()
![]() +2H2O
+2H2O


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源:设计必修二化学苏教版 苏教版 题型:022
有些元素在元素周期表中虽然既不同周期也不同主族,但它的化学性质与它的相邻周期中的左上方或右下方的另一主族元素相似,这称为对角线规则.请完成下列问题:
(1)简述对角线元素化学性质之所以相似的原因(以Li、Mg为例).
(2)锂在空气中燃烧时,除生成________外,也能生成微量的________.
(3)铍的最高价氧化物对应水化物是两性氢氧化物,证明这一结论的有关反应的离子方程式为________.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省高三上学期第三次月考化学试卷(普) 题型:填空题
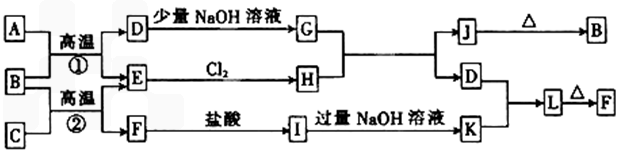
(10分)下图是一些常见的单质和化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为生活中最常用的金属单质,J为红褐色固体,L为两性氢氧化物。反应①、②均为工业上的重要反应。

请回答下列问题:
⑴写出B的化学式为 ;D的电子式为 。
⑵组成单质C的元素在元素周期表中的位置为 ;
⑶写出向I溶液中加入过量NaOH溶液时发生反应的离子方程式:
。
⑷写出向Na2SiO3溶液中通入少量D时发生反应的离子方程式:
。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com