
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、Ca(HCO3)2溶液中加入足量NaOH溶液:HCO3-+OH-=H2O+CO32- |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| D、氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| A、②④⑥ | B、②③⑥ |
| C、①②④ | D、②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子在核外运动时有确定的轨道和轨迹,电子云就是对其运动轨迹的准确描述 |
| B、原子核外电子在某一时刻的位置可以测定或计算出来 |
| C、人们常用小黑点的疏密程度来表示电子在原子核外出现的概率的大小 |
| D、电子云图中的小黑点表示电子的个数多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知有2mol Na218O2与足量的CO2充分反应,生成的碳酸钠中含18O的原子为NA个 |
| B、电解精炼镍时,当电源提供NA个电子时,阳极溶解的Ni2+应为0.5mol |
| C、标准状况下,22.4L SO2和O2的混合气体中含有的氧原子数为2NA |
| D、向足量MnO2中加入溶有4mol HCl的浓盐酸,加热,反应后的溶液中的Cl-数是2NA个(不考虑盐酸的挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO-酸性氧化物 Na2O-碱性氧化物 Al2O3-两性氧化物 |
| B、汽油-混合物 胆矾-纯净物 HD-单质 |
| C、苏打-碱 硫化氢-酸 小苏打-酸式盐 |
| D、液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
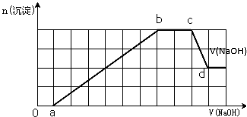
| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com