


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| A、若a1=a2,且混合溶液的pH<7,则b1>b2 |
| B、若混合溶液的pH<7,则a1b1=a2b2 |
| C、若混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) |
| D、若a1=a2,b1=b2,则混合溶液中c(CH3COO-)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
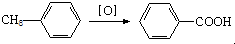 ;
;| CaO |
| △ |
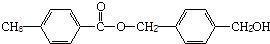 ,从A出发,可发生图示中的一系列反应.其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工分子水平的标志.
,从A出发,可发生图示中的一系列反应.其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工分子水平的标志.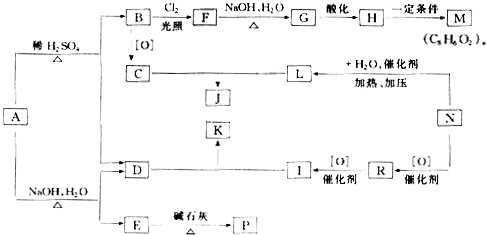
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
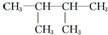 的系统命名为
的系统命名为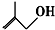 的分子式为
的分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容摇匀后发现液面低于刻度线,再加水至刻度线 |
| B、容量瓶中原来含有少量蒸馏水 |
| C、未洗涤烧杯和玻璃棒 |
| D、定容时俯视刻度线观察液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:H2SeO4>C12>H2SO3 |
| B、酸性:H2SO4>H2SeO4 |
| C、析出l mol硒需要消耗标准状况下22.4L SO2 |
| D、硒酸转化为亚硒酸的反应中氧化产物为Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com