
分析 先给个名称好区分,40%的盐水称为甲盐水,10%的盐水称为乙盐水,20%的盐水称为丙盐水.甲盐水和乙盐水的质量比=(30%-10%):(40%-30%)=2:1,甲乙混合后的盐水和丙盐水的质量比=(25%-20%):(30%-25%)=1:1,所以甲盐水和乙盐水共300克,由此即可求得甲种盐水的质量.
解答 解:根据题干分析可得:
甲盐水和乙盐水的质量比是=(30%-10%):(40%-30%)=2:1,
甲乙混合后的盐水和丙盐水的质量比是=(25%-20%):(30%-25%)=1:1,
所以甲盐水和乙盐水等于丙盐水的质量为300克,
原有40%的盐水的质量为300克×$\frac{2}{3}$=200克;
答:原有40%的盐水为200克.
点评 本题主要考查了溶液的混合计算,十字交叉法的使用是浓度计算的重要方法,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NaHS溶液中,S2-与HS-数目之和为0.1NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 4gD2O与4gH218O含有的中子数均为2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Y>X>W | |
| B. | Z与W形成的化合物中存在共价键 | |
| C. | 一定条件下Z3Y2与水反应可生成M | |
| D. | 工业上用W单质与澄清石灰水反应制取漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
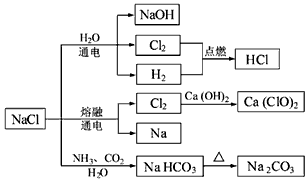
| A. | 石灰乳与Cl2的反应中,Cl2既作氧化剂,又作还原剂 | |
| B. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| C. | 图示的转化反应中有3个分解反应 | |
| D. | 图示的转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 gNa+中含有NA个电子 | |
| B. | 硫酸的摩尔质量与硫酸分子的质量相等 | |
| C. | NA个CC14分子在标准状况下的体积约为22.4 L | |
| D. | 18 g H2O中含有NA个H2、NA个O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 | |
| C. | 石英玻璃耐强酸强碱,高温下可用来熔融氢氧化钠 | |
| D. | Na2SiO3是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com