
| y |
| 4 |
| 点燃 |
| y |
| 2 |
| m |
| n |
| y |
| 4 |
| 点燃 |
| y |
| 2 |
| y |
| 4 |
| m |
| n |
| 2mol×30g/mol+3mol×28g/mol |
| 5mol |


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A、0.15mol CuO |
| B、0.1mol CuCO3 |
| C、0.075mol Cu(OH)2 |
| D、0.05mol Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀H2SO4吸收氨气:NH3+H+═NH4+ |
| B、少量的CO2通入NaOH溶液中:CO2+2OH-═CO32-+H2O |
| C、铜溶解于氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| D、足量铁溶于稀硝酸,溶液变成浅绿色:Fe+4H++NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
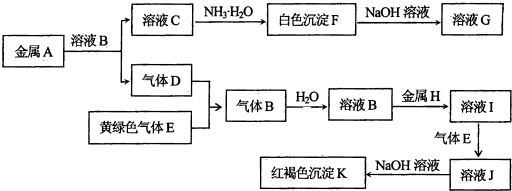
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
压强/MPa 体积分数/% 温度/℃ |
1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业制硝酸的主要反应为:
工业制硝酸的主要反应为:| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 时间 | |||
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)>c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2] |
| B、已知25℃时KSP(AgCl)=1.8×10-10,则在0.1mol?L-1 AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol?L-1 |
| C、0.2mol?L-1 HCl溶液与等体积0.05mol?L-1 Ba(OH)2溶液混合后,溶液的pH约为1 |
| D、0.1mol?L-1 NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com