
| A. | ①②③ | B. | ③④⑤ | C. | ②⑤⑥ | D. | ①④⑥ |
分析 ①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝;
②过氧化钠能与二氧化碳反应;
③氧化铁与盐酸反应生成氯化铁,Fe3+水解,加热蒸发得不到无水FeCl3;
④在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以析出NaHCO3,加热NaHCO3分解生成碳酸钠;
⑤氯化镁溶液蒸干得到氢氧化镁;
⑥硫酸铜中加入过量氢氧化钠生成氢氧化铜悬浊液,氢氧化铜能检验醛基.
解答 解:①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,发生反应2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,生成氢氧化铝,故①正确;
②过氧化钠能与二氧化碳反应,钠与二氧化碳不反应,故②错误;
③氧化铁与盐酸反应生成氯化铁,Fe3+水解Fe3++3H2O?2Fe(OH)3+HCl,加热蒸发HCl挥发,平衡向右移动,得不到无水FeCl3,故③错误;
④在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,析出NaHCO3,加热NaHCO3分解生成碳酸钠,故④正确;
⑤氯化镁溶液蒸干得到氢氧化镁,得不到氯化镁,故⑤错误.
⑥硫酸铜中加入过量氢氧化钠生成氢氧化铜悬浊液,氢氧化铜能检验醛基,葡萄糖中含有醛基,葡萄糖和新制氢氧化铜悬浊液发生氧化反应生成砖红色氧化亚铜,所以能一步实现,故⑥正确;
故选D.
点评 本题考查元素化合性质、侯德榜制碱法、盐类水解等,难度中等,注意侯德榜制碱法要先通氨气,后通二氧化碳,以便获得高浓度离子溶液.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 甘油(水):用分液漏斗分离 | |
| C. | 苯(苯酚):加NaOH溶液,充分振荡,分液 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA | |
| B. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| C. | 标准状况下,11.2L SO3 中含有2NA个原子 | |
| D. | 用石灰乳完全吸收1 mol Cl2时,转移电子的数目是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ||||||
| 4 | ⑧ | ⑨ | ||||||
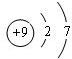 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Mg能放出H2的溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 存在较多的Fe3+的溶液中:HCO3-、Cl-、SO42- | |
| C. | 水电离产生的c(OH-)=1×10-10 mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| D. | 使甲基橙变红色的溶液中:Na+、AlO2-、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=3.0×10-8 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
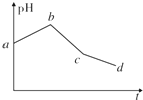 将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )
将物质的量浓度相等的KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如上图所示,则下列说法正确的是( )| A. | ab段表示电解过程中H+被还原,pH上升 | |
| B. | 电解开始时阳极先发生电极反应2Cl--2e-═Cl2↑ | |
| C. | 电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度 | |
| D. | 原混合溶液中KCl和CuSO4的浓度之比恰好为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | c(H+)=1.0×10-13mol/L溶液中:S2-、K+、SO32-、Br- | |
| C. | Na2S溶液中:SO42-、K+、Cl-、Al3+ | |
| D. | pH=12的溶液中:NO3-、I-、Na+、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com