
【题目】氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式______________________。
⑵NH2-的电子式为_______________。
⑶N3-有________个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式_____、____。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型___________________。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是___________。
【答案】 N2H62++2OH-=N2H4+2H2O ![]() 22 N2O CO2 CNO-BeF2 CaH2C3H4等 直线型 一个单位正电荷
22 N2O CO2 CNO-BeF2 CaH2C3H4等 直线型 一个单位正电荷
【解析】试题分析:⑴NH4+与碱反应的离子方程式为:NH4++OH-=NH3+H2O。由于NH4+与N2H62+结构相似,所以N2H62+在碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O。⑵NH2-是NH3失去质子后形成的。所以NH2-的电子式为![]() 。⑶N是7号元素,所以N3-有22个电子。⑷由多个原子组成的含有与N3-电子数相同的物质有N2O 、 CO2、 CNO-、BeF2、CaH2、C3H4等。⑸等电子数的微粒往往具有相似的结构,由于CO2与N3—是等电子体。所以N3—的构型是直线型。⑹其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。其结构为
。⑶N是7号元素,所以N3-有22个电子。⑷由多个原子组成的含有与N3-电子数相同的物质有N2O 、 CO2、 CNO-、BeF2、CaH2、C3H4等。⑸等电子数的微粒往往具有相似的结构,由于CO2与N3—是等电子体。所以N3—的构型是直线型。⑹其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。其结构为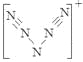 “N5”分子碎片所带电荷是一个单位正电荷。
“N5”分子碎片所带电荷是一个单位正电荷。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸钙与盐酸反应:CO32-+H+=H2O+CO2
B.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
C.硝酸与氢氧化钡反应:OH-+H+=H2O
D.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
![]()
(1)步骤I,CO变换反应的能量变化如下图所示:

①CO变换反应的热化学方程式是________________。
②一定条件下,向体积固定的密闭容器中充入aL半水煤气,发生CO变换反应。测得不同温度(T1,T2)氢气的体积分数ψ(H2)与时间的关系如下所示。
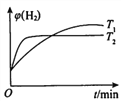
i.T1、T2的大小关系及判断理由是______________。
ii.请在上图中画出:其他条件相同时,起始充入0.5aL半水煤气,T2温度下氢气的体积分数ψ( H2)随时间的变化曲线。______________
(2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。
①溶液中离子浓度关系正确的是__________(选填字母)。
a.吸收前:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.吸收初期:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+)
c.吸收全进程:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-)
②后期析出固体的成分及析出固体的原因是___________。
③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示):____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.
(1)该氮氢化合物的电子式为 .
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式 .
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一全国性问题,我国已经开始实施“智力工程”,最经济可行的措施是
A. 食盐加碘(盐) B. 面包加碘(盐)
C. 大量食用海带 D. 注射含碘药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年的6月26日是国际禁毒日,珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是
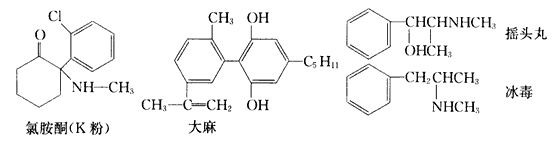
A. 四种毒品中都含有苯环,都属于芳香烃
B. 氯胺酮分子中所有碳原子可能共平面
C. 1 mol大麻与溴水反应最多消耗3molBr2
D. 摇头丸经过消去反应可制取冰毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
B. 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
C. 皮肤上溅有较多的浓硫酸,赶紧用水冲洗。
D. 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钴(CoCl2)可溶于水,常用作湿度和水分的指示剂,工业上也可用于制取钴。
(1)钴元素的常见化合价与铁元素相同。往CoCl2溶液中加入NaOH溶液产生粉红色沉淀,露置于空气中一段时间后,沉淀变为棕褐色。
① 化合态钴的常见化合价有_______。
② 沉淀由粉红色变为棕褐色反应的化学方程式为_______________。
(2)将CoCl2溶于浓盐酸中能形成[CoCl4]2-,溶液中存在平衡:[Co(H2O)6]2++4Cl-![]() [CoCl2]2-+6H2O
[CoCl2]2-+6H2O
T1℃时,将0.025mol CoCl2·6H2O溶于50mL 12mol/L浓盐酸中,再加水稀释至100 mL。溶液中c(Cl-)与温度(T)的关系如右图所示。

① Tl ℃时,取10mL上述溶液稀释至l00mL,稀释后的溶液中c(Cl-)______0.6mol·L-1(填“>”“=”或“<”)。
② 由图可知,上述反应的△H______0(填“>”“=”或“<”)。
③ 根据A点数据,计算出T1℃时上述反应的平衡常数为________。
(3)采用下图所示装置(Ti-Ru电极为惰性电极)电解CoCl2溶液制取钴。Co能与强酸反应产生H2,不利于Co的沉积,故电解过程中,CoCl2溶液的pH通常控制在3.9~4.2。

① Co沉积在_______(填“Ti-Ru”或“Ti”) 电极上。
② CoCl2溶液中常含有少量Cu2+、Fe3+、Na+等,为提高产品的纯度和电流效率,电解前必须将其中的_______(填离子符号)除去。
③ 若用CoSO4溶液代替CoCl2溶液,会使产率降低。其原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com