
【题目】下列事实不能用勒夏特列原理解释的是
①工业合成氨N2(g)+3H2(g)![]() 2NH3(g) △H<0,反应条件选择高温
2NH3(g) △H<0,反应条件选择高温
②实验室可以用排饱和食盐水的方法收集氯气
③硫酸工业中2SO2+O2![]() 2SO3,增大O2的浓度有利于提高SO2的转化率
2SO3,增大O2的浓度有利于提高SO2的转化率
④对CO(g)+NO2(g)![]() CO2(g) + NO(g)平衡体系增大压强可使颜色变深
CO2(g) + NO(g)平衡体系增大压强可使颜色变深
A. ②③ B. ②④ C. ①③ D. ①④
【答案】D
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
①合成氨:N2(g)+3H2(g)![]() 2NH3 (g)△H<0在高温平衡逆向移动,不利于氨的合成,符合题意;
2NH3 (g)△H<0在高温平衡逆向移动,不利于氨的合成,符合题意;
②氯气与水发生可逆反应生成HCl和HClO,在饱和食盐水中增大氯离子浓度,使氯气的溶解度减小,氯气难溶于饱和食盐水,可用排饱和食盐水收集氯气,故不合题意。
③硫酸工业中2SO2+O2![]() 2SO3,增大O2的浓度,平衡正向移动,有利于提高SO2的转化率,故不合题意;
2SO3,增大O2的浓度,平衡正向移动,有利于提高SO2的转化率,故不合题意;
④对CO(g)+NO2(g)![]() CO2(g) + NO(g)平衡体系增大压强,平衡不移动,可使颜色变深,是因为体积减小,是物理变化。故符合题意。
CO2(g) + NO(g)平衡体系增大压强,平衡不移动,可使颜色变深,是因为体积减小,是物理变化。故符合题意。
故①④符合题意,故选D。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】根据下图两套基础实验装置回答问题。

(1)写出下列仪器的名称:______________、___________________。
(2)仪器①~④中,使用时必须检查是否漏水的有____________________。(填序号)
(3)用装置I制蒸馏水,还缺少的仪器有_________,冷却水从_______口进。
(4)a.现需配制250mL0.2molL-1NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是_______________,_______________。
b.配制过程中,下列情况会使配制结果偏高的是________________(填序号)。
①定容时俯视刻度线观察液面;②容量瓶使用时未干燥;③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;④移液时未洗涤烧杯和玻璃棒
c.若实验中加蒸馏水时不慎超过了刻度,应如何处理?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
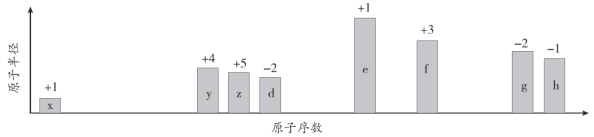
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同)______>_______;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>____。
(3)画出x2d2的电子式:____________________;
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________。
(5)写出用惰性电极电解eh溶液的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述正确的是( )
A.常温下所有的金属都是固体
B.金属具有导电性、导热性和延展性
C.所有金属都能与酸反应
D.金属元素在自然界中都是以化合态形式存在的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属元素及其化合物在物质制备、生产生活中发挥着重要作用。
I.CO2与NH3合成尿素的反应如下:CO2(g)+2NH3(g)![]() [CO(NH2)2](s)+H2O(g) △H=akJ/mol
[CO(NH2)2](s)+H2O(g) △H=akJ/mol
曲线表示不同温度、不同压强下,CO2的平衡转化率与温度的关系,请回答下列问题:

(1)a__________0,P1__________P2(填“>”、“<”或“=”)。
(2)t℃时,向容积为2L的密闭容器中充入3molNH3和1molCO2,实现M点的平衡,则
①平衡时容器内压强为开始时的____________倍,t℃时的化学平衡常数为__________。
②若保持条件不变,再向该容器中充入1molNH3和1molCO2,NH3的转化率将________(填“增大”、“减小”或“不变”)。
II.硫及其化合物在生产生活中应用广泛,回答下列问题。
(1)铁铵矾是一种化学物质,分子式为NH4Fe(SO4)212H2O,其溶于水后,溶液中离子浓度大小关系为________________________________。
(2)已知某溶液中含有CO32-、SO42-等离子,取一定量的该溶液向其中加入 BaCl2溶液,当CO32-开始沉淀时,溶液中![]() 为____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
为____________。(已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO4)=2.5×10-9)
(3)恒温恒容密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol。下列能说明反应达到平衡状态的是___________。
2SO3(g) △H=-197kJ/mol。下列能说明反应达到平衡状态的是___________。
a.体系压强保持不变 b.混合气体的密度保持不变
c.SO3和O2的体积比保持不变 d.每消耗1molSO3的同时生成0.5molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称分别是:![]() ,下列有关推断正确的是
,下列有关推断正确的是
A. 这五种元素均为主族元素
B. 根据该名称,周期表118种元素中非金属元素共有24种
C. Nh的最高价氧化物是一种典型的两性氧化物
D. Ts的简单阴离子比该族上一周期简单阴离子的还原性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol
③0.1molL-1的A、B溶液各10mL ④0.5molL-1的A、B溶液各50mL
四者反应速率的大小关系是
A. ②>①>④>③ B. ④>③>②>①
C. ①>②>④>③ D. ①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,3.2 g 14C18O中含中子数为1.4NA
B. CO燃烧热为283.0 kJ/mol,若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为NA
C. 等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和相等
D. 室温下,21.0 gC2H4和C4H8的混合气体中含有的原子数目为4.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com