

���� ��1������ǽ��Ƽ����Դ�����������Ʋ����Դ����������
��2��������ͭ�ν��л�ѧ��ͭ��������ͭ���ӵõ��ӷ���������Ӧ��������Ҫ��ԭ����֮��Ӧ��
�ڸ���ͼ֪����Һ��pHԽ��Ӧ����Խ����ͨ��������ҺpH���Ʒ�Ӧ���ʣ�
��3��ͭ���м������ϡ���ᣬ�����ķ�Ӧ��Cu2��OH��2CO3+2H2SO4=2CuSO4+CO2��+3H2O����Һ�н�����������Cu2+��Fe2+��Fe3+����Һ�����ԣ�����̼����泥�̼��������Ӻ������ӷ�Ӧ���ɶ�����̼���Ӷ�������ҺpH������Һ�м��������������̣����������£��������̺��������ӷ�Ӧ���������ӡ������Ӻ�ˮ������Һ�м�������泥�����狀������ӷ�Ӧ���ɳ���NH4Fe3��SO4��2��OH��6�����ù��˷��������������Һ��Ȼ��ͨ������Ũ������ȴ�ᾧ�õ�����ͭ���壬�ٽ����Ŀ�������
��� �⣺��1������ǽ��Ƽ����Դ�����������Ʋ����Դ����������
�ʴ�Ϊ������
��2��������ͭ�ν��л�ѧ��ͭ��������ͭ���ӵõ��ӷ���������Ӧ��������Ҫ��ԭ����֮��Ӧ��
�ʴ�Ϊ����ԭ����
�ڸ���ͼʾ��Ϣ��pH=8-9֮�䣬��Ӧ����Ϊ0������Ҫʹ��Ӧֹͣ��������Һ��pH��8-9 ֮�䣬
�ʴ�Ϊ��������Һ��pH��8-9 ֮�䣻
��3��ͭ���м������ϡ���ᣬ�����ķ�Ӧ��Cu2��OH��2CO3+2H2SO4=2CuSO4+CO2��+3H2O����Һ�н�����������Cu2+��Fe2+��Fe3+����Һ�����ԣ�����̼����泥�̼��������Ӻ������ӷ�Ӧ���ɶ�����̼���Ӷ�������ҺpH������Һ�м��������������̣����������£��������̺��������ӷ�Ӧ���������ӡ������Ӻ�ˮ������Һ�м�������泥�����狀������ӷ�Ӧ���ɳ���NH4Fe3��SO4��2��OH��6�����ù��˷��������������Һ��Ȼ��ͨ������Ũ������ȴ�ᾧ�õ�����ͭ���壬
�ټ�ʽ̼��ͭ�����ᷴӦ��������ͭ��������̼��ˮ����Ӧ����ʽΪCu2��OH��2CO3+2H2SO4=2CuSO4+CO2��+3H2O��
�ʴ�Ϊ��Cu2��OH��2CO3+2H2SO4=2CuSO4+CO2��+3H2O��
����ĿҪ�����pH��笠����������ԣ�̼����������Լ��ԣ��������õ�������̼��������ӣ�
�ʴ�Ϊ��HCO3-��
���������������ӱ���������ӣ�1mol MnO2ת�Ƶ���2 mol������Ԫ�ش�+4���+2�ۣ���Һ�������Եģ�����ʽ�����۲��Ҫ���������ӣ��ۺ�����������д�����ӷ���ʽΪMnO2+2Fe2++4H+=Mn2++2Fe3++2H2O��
�ʴ�Ϊ��MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O��
���˺�ĸҺ��pH=2.0����c��H+��=0.01mol/L��c��Fe3+��=a mol•L-1��c��NH4+��=b mol•L-1��c��SO42-��=d mol•L-1��
�÷�Ӧ��ƽ�ⳣ��K=$\frac{{c}^{6}��{H}^{+}��}{{c}^{3}��F{e}^{3+}��c��N{{H}_{4}}^{+}��{c}^{2}��S{{O}_{4}}^{2-}��}$=$\frac{��0.01��^{6}}{{a}^{3}��b��{d}^{2}}$=$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$��
�ʴ�Ϊ��$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$��
���� ���⿼�����ʷ�����ᴿ���ۺ�Ӧ�ü����ԭ�������ؿ���ѧ��������������ȷ����ͼ�з����ķ�Ӧ�����뷽���ǽⱾ��ؼ�����ϤԪ�ػ��������ʼ�����ԭ�����ѵ��Ƕ������̺��������ӷ�Ӧ����ʽ����д����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
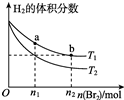 �����ΪV L�ĺ����ܱ�������ʢ��һ����H2��ͨ��Br2��g��������Ӧ��H2��g��+Br2��g��?2HBr��g����H��0�����¶ȷֱ�ΪT1��T2����ƽ��ʱ��H2�����������Br2��g�������ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
�����ΪV L�ĺ����ܱ�������ʢ��һ����H2��ͨ��Br2��g��������Ӧ��H2��g��+Br2��g��?2HBr��g����H��0�����¶ȷֱ�ΪT1��T2����ƽ��ʱ��H2�����������Br2��g�������ʵ����仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ��ͼ��֪��T1��T2 | |
| B�� | a��b���������Ӧ���ʣ�b��a | |
| C�� | Ϊ�����Br2��g����ת���ʣ�����������������ʱ���������ΪV/2 L | |
| D�� | T1ʱ������Br2��g�����룬ƽ��ʱHBr����������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʵʩ����ȼ�ϵ����������������Լ���SO2��NOx���ŷ� | |
| B�� | PM2.5��ֱ����2.5��ϸ������������������ж��к����� | |
| C�� | O3������ɱ����������O3Ũ��Խ��Խ���������彡�� | |
| D�� | ����β���е�CO��Ҫ�������͵IJ���ȫȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2NO2?N2O4 ������ӦΪ���ȷ�Ӧ�� | |
| B�� | C��s��+CO2?2CO ������ӦΪ���ȷ�Ӧ�� | |
| C�� | N2+3H2?2NH3 ������ӦΪ���ȷ�Ӧ�� | |
| D�� | H2S?H2+S��s�� ������ӦΪ���ȷ�Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
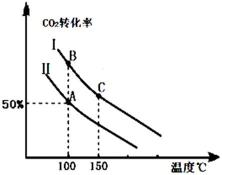
 ����ͼ��ش����ߢ�NOת�������¶����߶������ԭ��Ӧû�дﵽƽ�⣬�¶�Խ�߷�Ӧ����Խ�죬ת����Խ����ͼ2�л�����Ӧ2NO��g��+2CO��g��?N2��g��+2CO2��g���ڲ�ͬ�¶��´ﵽƽ��ʱc��N2���ı仯����ͼ��
����ͼ��ش����ߢ�NOת�������¶����߶������ԭ��Ӧû�дﵽƽ�⣬�¶�Խ�߷�Ӧ����Խ�죬ת����Խ����ͼ2�л�����Ӧ2NO��g��+2CO��g��?N2��g��+2CO2��g���ڲ�ͬ�¶��´ﵽƽ��ʱc��N2���ı仯����ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʵ�����������������ֱ���ȫȼ�գ����߷ų������� | |
| B�� | ��C��ʯī��=C�����ʯ����H=+1.90 kJ/mol��֪�����ʯ��ʯī�ȶ� | |
| C�� | ��101 kPaʱ��2 g������ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g���T2H2O��l����H=-285.8 kJ/mol | |
| D�� | ��ϡ��Һ�У�H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ/mol��������0.5 mol H2SO4��Ũ�����뺬1 mol NaOH����Һ��ϣ��ų����ȴ���57.3 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڸ������£���Ӧǰ���ѹǿ֮��Ϊ6��5.3 | |
| B�� | ����Ӧ��ʼʱ�������Ϊ2 L����0��2 min��v��SO3��=0.35 mol/��L•min�� | |
| C�� | ���ѡ����º�ѹ�¡���Ϊ����ѹ���������¡���Ӧ��ƽ���n��SO3����1.4 mol | |
| D�� | ���ѡ����º�ѹ�¡���Ϊ�����º����¡���Ӧ����ƽ��ʱ�ų�����������Q kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 1905��¹���ѧ�ҹ��������˺ϳɰ��ķ���������˻����1918���ŵ������ѧ�������ĺϳɲ�������˵���������ʳ��������µļ������������⣬�ڹ�������Դ���Ṥҵ����Ҳ�й㷺��;��
1905��¹���ѧ�ҹ��������˺ϳɰ��ķ���������˻����1918���ŵ������ѧ�������ĺϳɲ�������˵���������ʳ��������µļ������������⣬�ڹ�������Դ���Ṥҵ����Ҳ�й㷺��;���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com