
【题目】碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O,下列说法正确的是( )
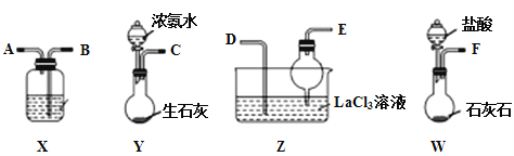
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
D.实验开始时应先打开Y中分液漏斗的旋转活塞
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案中,不能达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 除去乙烯、甲烷混合气中的乙烯 | 比较Cl2、I2的氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
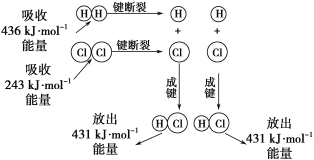
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中发生反应C(s)+H2O(g)![]() CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
A.断裂氢氧键速率是断裂氢氢键速率的2倍
B.混合气体平均相对分子质量不再改变
C.单位时间内消耗水与生成氢气的质量比为9∶1
D.混合气体的物质的量不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池的结构示意图如图:
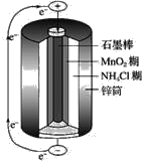
电池总反应式:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑+H2O,回答下列问题:
(1)锌锰干电池的负极是__,电极反应式是__。
(2)锌锰干电池的正极是_,电极反应式是__。
(3)锌锰干电池又称一次性电池的原因是__。
(4)锌锰干电池的有缺陷是__,改进的方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
D.已知C(石墨,s)==C(金刚石,s)ΔH>0,则石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置_____________.
(2)D的最高价氧化物的水化物电子式___________,所含化学键类型____________.
(3)B、C、D、E简单离子半径由大到小顺序为_____________(用离子符号表示).
(4)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
(Ⅱ)工业上冶炼铝的流程图如图所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:

(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A. 水玻璃中通入过量的二氧化碳: Na2SiO3+CO2+H2O===2Na++CO![]() +H2SiO3
+H2SiO3
B. 澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2===Ca2++2HCO![]()
C. 二氧化硅与氢氟酸反应:SiO2+4H++4F-===SiF4↑+2H2O
D. 二氧化硅溶于烧碱溶液中:SiO2+2OH-===SiO![]() +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com