
| A. | 仅①②③ | B. | 仅①③④ | C. | 仅①③⑤ | D. | 仅②③④ |
分析 ①加水促进电离;
②0.1mol/L氨水加水时碱性减弱,KW只受温度影响,温度不变离子积常数不变;
③0.1mol/L氨水加水时碱性减弱;
④离子的浓度越大,导电性越强;
⑤加水时电离平衡正向移动,n(OH-)增大,n(NH3•H2O)减小.
解答 解:①因加水促进弱电解质的电离,则氨水的电离程度增大,故①正确;
②0.1mol/L氨水加水时碱性减弱,c(OH-)减小,c(H+)增大,$\frac{c({H}^{+})}{c(O{H}^{-})}$比值增大,故②错误;
③0.1mol/L氨水加水时碱性减弱,c(OH-)减小,c(H+]增大,故③正确;
④加水稀释时,溶液中的离子的浓度减小,则导电性减弱,故④错误;
⑤加水时电离平衡正向移动,n(OH-)增大,n(NH3•H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大,故⑤正确;
故选C.
点评 本题考查加水对氨水电离平衡的影响,明确离子的物质的量的变化与浓度的变化的区别是解答的关键,并注意稀释时溶液的体积增大来分析解答,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下11.2 L氢气所含的原子数目为NA | |
| B. | 18 g水所含的氢原子数目为NA | |
| C. | 2.3 g金属钠转化为Na2O和Na2O2的混合物时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

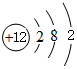 ,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C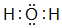 ,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.
,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和NO | B. | CO和NO | C. | CO2和O2 | D. | 碳氢化合物和O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molOH-所含质子数为10NA | |
| B. | 常温常压下,28克CO和N2的混合气体所含原子数为2NA | |
| C. | 4g氢气中含有的原子数为2NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com