
【题目】1-溴丁烷(密度1.2758 g/mL)是重要的有机合成中间体及有机溶剂,可以在实验室里用溴化钠、浓硫酸和1-丁醇为原料,经过如图六步制得。

完成下列填空:
(1)通过步骤②获得粗产品,反应的化学方程式是___。此时产品往往呈红棕色,原因是____。实验室里有下列常用试剂,请根据实验需要为与步骤④相关的(2)(3)小题选择试剂,并用试剂编号填空:
a.NaOH溶液 b.NaHCO3溶液 c.NaHSO3 溶液 d.NaBr溶液
(2)产品的红棕色可用___除去(填写试剂编号),相应的离子方程式为___。
(3)选用浓硫酸洗去未反应的1-丁醇和有机副产物,然后除酸。最适宜的除酸试剂是__(填写试剂编号)。
(4)用浓硫酸(密度1.84g/mL)洗涤时,采用___(填写仪器名称)分离出___(填写“上”或“下”)层产物。
(5)检验产物中含有溴元素的实验方法是____。
【答案】NaBr+H2SO4(浓)→NaHSO4+HBr、HBr+CH3CH2OH→CH3CH2Br+H2O 浓硫酸具有强氧化性,溴离子具有还原性,部分溴化物被氧化成溴,导致产品呈红棕色 C Br2+SO32-+H2O→2Br-+2H+ +SO42- b 分液漏斗 上 取样,加入氢氧化钠溶液并加热,用稀硝酸调节到酸性,再滴入硝酸银溶液,有淡黄色沉淀产生
【解析】
(1)溴化钠与浓硫酸得到HBr,1-丁醇与HBr发生取代反应生成1-溴丁烷;浓硫酸具有强氧化性,可以将溴离子氧化为溴单质;
(2)强碱容易使1-溴丁烷水解,溴具有强氧化性,可以用还原性的NaHSO3溶液除去;
(3)碳酸氢钠溶液显弱碱性,可以除去剩余的硫酸;
(4)浓硫酸与有机物不互溶,采用分液方法分离,浓硫酸的密度比1-溴丁烷大;
(5)先在碱性条件下水解,再用硝酸酸化的硝酸银溶液检验。
(1)溴化钠与浓硫酸得到HBr,1-丁醇与HBr发生取代反应生成1-溴丁烷,反应方程式为:NaBr+H2SO4(浓)→NaHSO4+HBr、HBr+CH3CH2OH→CH3CH2Br+H2O;浓硫酸有强氧化性,溴离子有还原性,部分溴化物被氧化成溴,导致产品往往呈红棕色;
(2)强碱容易使1-溴丁烷水解,溴具有强氧化性,可以用还原性的NaHSO3溶液除去,反应离子方程为:Br2+HSO3-+H2O=3H++SO42-+2Br-;
(3)碳酸氢钠溶液显弱碱性,最适宜除去剩余的硫酸,氢氧化钠溶液碱性太强,亚硫酸氢钠溶液反应会生成二氧化硫气体,溴化钠溶液与少量硫酸不反应,故选:b;
(4)浓硫酸与有机物不互溶,采用分液方法分离,需要用分液漏斗分离,浓硫酸的密度比1-溴丁烷大,有机层在上层;
(5)检验产物中含有溴元素的实验方法是:取少量产品样品,加入NaOH溶液并加热,用稀硝酸调至酸性,加入硝酸银溶液,产生淡黄色沉淀。


科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),达到平衡后测得A气体的浓度为0.5 mol/L,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.75 mol/L,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol/L,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.75 mol/L,则下列叙述正确的是
A.平衡向逆反应方向移动B.x+y<z
C.B的物质的量浓度减小D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
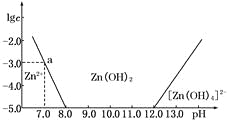
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
c(HCl) | |||||||
(mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
103c(PbCl2) | |||||||
(mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 14.01 |
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
D.PbCl2固体可溶于饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 只含有
只含有![]() 、
、![]() 、
、![]() 三种元素,常用作有机合成的中间体。
三种元素,常用作有机合成的中间体。![]() 该有机物在足量
该有机物在足量![]() 中充分燃烧生成
中充分燃烧生成![]()
![]() 和
和![]()
![]() ,质谱图表明其相对分子质量为84,分析其红外光谱图可知
,质谱图表明其相对分子质量为84,分析其红外光谱图可知![]() 分子中含有
分子中含有![]() 键和位于端点处的
键和位于端点处的![]() 键,核磁共振氢谱上有三组峰,峰面积之比为
键,核磁共振氢谱上有三组峰,峰面积之比为![]() 。
。
(1)![]() 的分子式是______。
的分子式是______。
(2)![]() 的结构简式是______。
的结构简式是______。
(3)下列物质中,一定条件下能与![]() 发生反应的是______(填序号)。
发生反应的是______(填序号)。
A.![]() B.
B.![]()
C.酸性![]() 溶液 D.
溶液 D.![]() 的
的![]() 溶液
溶液
(4)有机物![]() 是
是![]() 的同分异构体,
的同分异构体,![]()
![]() 最多可与
最多可与![]()
![]() 完全加成。已知
完全加成。已知![]() 中所有碳原子在同一个平面上,且没有顺反异构现象,则
中所有碳原子在同一个平面上,且没有顺反异构现象,则![]() 的结构简式为______。
的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然水因含有Ca2+、Mg2+、HCO3—等离子,煮沸后会形成水垢。现有一种干燥水垢6.32g ,加热除去全部结晶水,得到固体M 5.78 g;高温灼烧M至恒重,残余固体为CaO和MgO;放出的气体通入足量澄清石灰水中,产生沉淀6.00g;若产生的气体完全被碱石灰吸收,碱石灰增重2.82g。下列推断合理的是( )
A.M 中一定不含Mg(OH)2B.M中一定含有MgCO3
C.5.78 g M中含CaCO30.05molD.水垢中碳酸盐质量分数为0.823
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是CO2生产甲醇的能量变化示意图.下列说法正确的是( )

A.E2_E1是该反应的热效应
B.E3_E1是该反应的热效应
C.该反应放热,在常温常压下就能进行
D.实现变废为宝,且有效控制温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
A | 是短周期元素(稀有气体元素除外)中原子半径最大的元素,含该元素的某种合金是原子反应堆的导热剂 |
B | 与A同周期,其最高价氧化物对应的水化物呈两性 |
C | 其气态氢化物极易溶于水,液态时常用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的杀菌消毒剂 |
E | 元素原子的 |
请根据表中信息回答下列问题。
(1)![]() 元素原子的核外电子排布式为______。
元素原子的核外电子排布式为______。
(2)![]() 元素在元素周期表中的位置为______;离子半径:
元素在元素周期表中的位置为______;离子半径:![]() ______(填“
______(填“![]() ”或“
”或“![]() ”)
”)![]() 。
。
(3)![]() 元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
(4)![]() 元素原子的核外电子排布式为______,
元素原子的核外电子排布式为______,![]() 的结构示意图为______。
的结构示意图为______。
(5)![]() 、
、![]() 元素的第一电离能的大小关系是______(用元素符号表示)。
元素的第一电离能的大小关系是______(用元素符号表示)。
(6)已知![]() 分子中
分子中![]() 元素显
元素显![]() 价,则该情况下,
价,则该情况下,![]() 、
、![]() 元素的电负性大小关系是______(用元素符号表示),
元素的电负性大小关系是______(用元素符号表示),![]() 与水反应后的产物是______(填化学式)。
与水反应后的产物是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)已知H2(g)、CO(g)和CH3OH(l )的燃烧热△H分别为285.8kJ·mol1、283.0kJ·mol1和726.5kJ·mol1。请回答下列问题:
①写出表示H2燃烧热的热化学反应方程式____________________。
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________________。
(2)以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)= CO(g)+3H2(g) △H=+206.0kJ/mol
Ⅱ.CO(g)+2H2(g)= CH3OH(g) △H=-129.0kJ/mol
①将2.0mol CH4和1.0mol H2O(g)通入容积为2L的反应容器,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。在100℃时达到平衡所需的时间为5min,则用CO表示该反应的平均反应速率为_________________。100℃时反应Ⅰ的平衡常数为_________________。
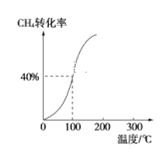
②工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g) ![]() CO(g)+2H2(g),请描述在其他条件不变时,温度对甲醇转化率的影响:____________________。
CO(g)+2H2(g),请描述在其他条件不变时,温度对甲醇转化率的影响:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com