
| A、铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O | ||||
B、燃煤中加入生灰石可以减少SO2的排放:O2+2CaO+2SO2
| ||||
| C、用氢氟酸蚀刻玻璃:SiO2+4HF=SiF4↑+2H2O | ||||
| D、将明矾放入浑浊的河水中,可使水澄清:Al3++3H2O=Al(OH)3↓+3H+ |
| ||


科目:高中化学 来源: 题型:
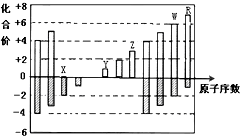
| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:W>R |
C、X的一种氢化物具有氧化性,其电子式为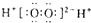 |
| D、Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
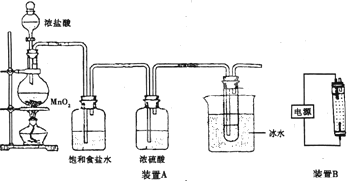
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O2的电子式: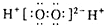 |
| B、结构简式(CH3)2CHOH可以表示1-丙醇,也可以表示2-丙醇 |
| C、二氧化硅的分子式:SiO2 |
| D、质子数为8,中子数为10的氧原子:818O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.0g/mol |
| B、5.0g/mol |
| C、10.0g/mol |
| D、4.0g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤ | B、②④⑤⑦ |
| C、②⑤⑥⑦ | D、全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.6 | 5.6 |
| Zn(OH)2 | 6.0 | 8.0 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
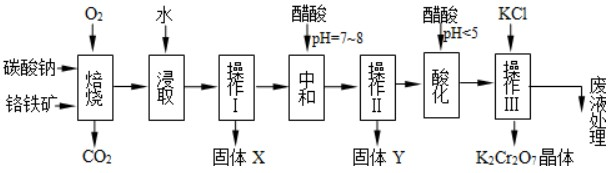
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
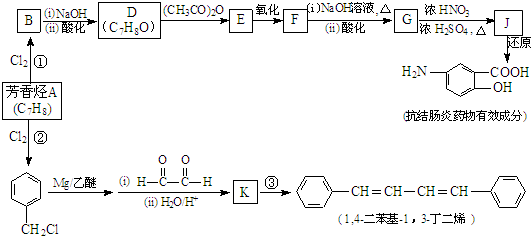
| ||
| (i)R′CHO |
| (ii)H2O/H+ |
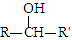 (R、R′表示烃基)
(R、R′表示烃基)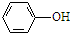
| (CH3CO)2O |
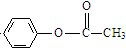
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com