
| A. | 6 | B. | 12 | C. | 18 | D. | 24 |
科目:高中化学 来源: 题型:解答题
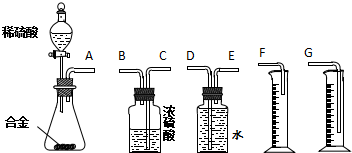
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “洧水”的主要成分是油脂 | B. | “洧水”的主要成分是煤油 | ||
| C. | “洧水”的主要成分是石油 | D. | 其烟的主要成分是石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰用作食品抗氧化剂 | |
| B. | 盐类都可作调味品 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 小苏打是面包发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2 L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 | |
| B. | 1 mol氢气与1mol氟气反应生成2mol气态氟化氢放出270 kJ热量 | |
| C. | 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com