
| A、22.4 L CO2中含有分子数为NA |
| B、常温常压下,28 g N2所含有的分子数为NA |
| C、1 L K2SO4溶液中N(K+)=4NA,则 c(K2SO4)=4 mol/L |
| D、物质的量浓度均为1 mol/L,体积均为1L的CH3COOH和HNO3溶液,电离出的H+数都为NA |
| m |
| M |
| N |
| NA |
| n |
| V |
| 1 |
| 2 |
| 2mol |
| 1L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:4 |
| C、3:4 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式:CH2CH2 |
| B、乙醇含有的官能团是-OH,带一个单位负电荷 |
C、丙烷的球棍模型为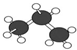 |
| D、乙酸的分子式:C2H4O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O2固体中含离子总数为4NA |
| B、将含0.1 mol FeCl3的饱和溶液制成胶体后,生成0.1NA个Fe(OH)3胶粒 |
| C、高温下,0.3 mol Fe与足量水蒸气反应,生成的H2分子数目为0.4 NA |
| D、1 mol FeI2与足量氯气反应时转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,48g O3体积为22.4L |
| B、50ml 0.2mol/L的CuCl2溶液中,Cl-的数目为0.02NA |
| C、11.2LNH3 含分子数为0.5NA |
| D、2.4g金属镁变为镁离子时失去的电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该气体的相对分子质量是44 |
| B、该气体的体积是22.4L |
| C、该气体的质量是44G |
| D、该气体的原子数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2、SO2、CO都是酸性氧化物 |
| B、酒精、烧碱、冰醋酸都是电解质 |
| C、雾、稀豆浆、氯化铁溶液都是胶体 |
| D、氨水、空气、漂白粉都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离出来的c(H+)=10-12 mol?L-1的溶液中:Cl-、CO32-、K+、SO32- |
| B、含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| C、使甲基橙变红的溶液中:Fe2+、K+、NO3-、SO42- |
| D、使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com