
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:
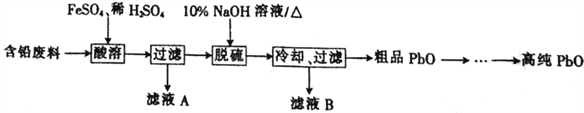
(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
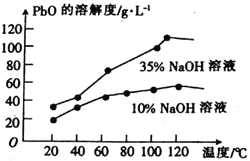
【答案】 -4 -2 将含铅废料粉碎(或加热等其他合理答案) H+、Fe2+ PbSO4+2OH-![]() PbO+SO42- +H2O 玻璃棒 漏斗 取最后一次的洗涤液。做焰色反应实验,火焰不变黄色(或取最后一次的洗涤液。滴入BaCl2溶液,若不产生白色沉淀),则说明已洗涤干净 将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃左右,充分溶解后,趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO
PbO+SO42- +H2O 玻璃棒 漏斗 取最后一次的洗涤液。做焰色反应实验,火焰不变黄色(或取最后一次的洗涤液。滴入BaCl2溶液,若不产生白色沉淀),则说明已洗涤干净 将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃左右,充分溶解后,趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO
【解析】(1)含铅废料中的PbO2和PhSO4中,铅的化合价分别为+4、 +2;(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有将含铅废料粉碎、适当升高温度、适当增大酸的浓度等;(3) 含铅废料中加入硫酸亚铁和硫酸溶解,生成硫酸铅为滤渣,滤液A中含有过量的硫酸和硫酸亚铁,故主要阳离子是H+、Fe2+;(4)脱硫过程发生是将硫酸铅转化为PbO,主要反应的离子方程式为PbSO4+2OH-![]() PbO+SO42-+H2O;(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、玻璃棒、漏斗,检验沉淀是否洗条干净的方法是取最后一次的洗涤液,做焰色反应实验,火焰不变黄色(或取最后一次白洗涤液.滴入BaCl2溶液,若不产生白色沉淀),则说明已洗涤干净;(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)
PbO+SO42-+H2O;(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、玻璃棒、漏斗,检验沉淀是否洗条干净的方法是取最后一次的洗涤液,做焰色反应实验,火焰不变黄色(或取最后一次白洗涤液.滴入BaCl2溶液,若不产生白色沉淀),则说明已洗涤干净;(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作: 将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃左右,充分溶解后,趁热过滤,将溶液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
NaHPbO2(aq)PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作: 将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃左右,充分溶解后,趁热过滤,将溶液冷却结晶,过滤、洗涤并干燥得到高纯PbO。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际单位制的七个基本物理量之一
B.物质的量是表示数量的单位
C.摩尔是物质的量的单位,符号为mol
D.1mol任何物质都含有约6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A.左、下方区域的金属元素
B.金属元素和非金属分界线附近的元素
C.右、上方区域的非金属元素
D.稀有气体元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( ) 
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72﹣和CrO42﹣ , 它们会对人类及生态系统产生很大的伤害,必须进行处理;常用的处理方法之一为还原沉淀法生成Cr(OH)3而除去.
(1)Cr2O72﹣和CrO42﹣之间存在相互转化:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O,能说明反应达平衡状态的是 . a.Cr2O72﹣和CrO42﹣的浓度相同 b.2v (Cr2O72﹣)=v (CrO42﹣) c.溶液的颜色不变
(2)常温下,Cr(OH)3的溶度积Ksp=1×10﹣32 , 要使c(Cr3+)降至1×10﹣5mol/L以下,溶液的pH应调至以上.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,其说明书部分内容摘录如下: 【规格】每片含琥珀酸亚铁0.1g
【适应症】用于缺铁性贫血症,预防及治疗用.
【贮藏】避光、密封、在干燥处保存.
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大
该药品中Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用.
(1)实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应).滴定过程发生如下反应,请补充完整: Fe2++MnO4﹣+=Mn2+++ .
(2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是 . (填名称)
(3)取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L﹣1的KMnO4溶液滴定,某同学设计了图2滴定方式(夹持部分略去),最合理的是(填字母序号);若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率(填偏高、偏低或不变).
(4)三次操作读数如下:
序号 | V初 | V末 | V标 |
① | 0.10mL | 9.71mL | 9.61mL |
② | 1.50mL | 11.09mL | 9.59mL |
③ | 0.50mL | 11.10mL | 11.60mL |
计算该“速力菲”补铁药品Fe2+的氧化率为%.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式“H++OH﹣═H2O”表示的化学反应是( )
A.4HNO3 ![]() 2H2O+4H2O↑+O2↑
2H2O+4H2O↑+O2↑
B.NaOH+HCl═NaCl+H2O
C.CaCO3+2HCl═CaCl2+CO2↑+H2
D.2H2+O2 ![]() 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是人类最理想的能源。已知在25℃、101 kPa下,1 g 氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
A.2H2+O2=2H2O ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l)ΔH=-142.9 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)ΔH=+571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(C4H10O)是一种有机溶剂.A可以发生以下变化: 
(1)A分子中的官能团名称是 .
(2)若A只有一种一氯取代物B.写出由D转化为E的化学方程式: .
(3)若A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种. 则F的结构简式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com