
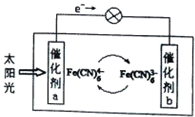
 一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A、K+移向催化剂b |
| B、催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63- |
| C、Fe(CN)63-在催化剂b表面被氧化 |
| D、电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、元素W与元素X形成的含有共价键的化合物只有一种 |
| B、元素X的单质与元素Y的单质反应时,反应条件不同,产物也不同 |
| C、元素Y与元素W可以原子个数比为1:1的化合物甲,且甲与水反应有气体产生 |
| D、元素Z的单质与元素W.Y的单质都能反应,且反应中Z的单质都做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蓄电池放电时,电路中每转移2mol电子,最多有1mol PbO2被还原 |
| B、电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
| C、电解后,c(Na2SO4)不变,且溶液中有晶体析出 |
| D、蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能与Cu反应产生气体的溶液:Na+、Fe2+、Cl-、SO42- |
| B、滴入甲基橙显红色的溶液:K+、Cu2+、NO3-、I- |
| C、由水电离出的C(H+)?C(OH-)═10-24溶液:K+、Na+、NO3-、Cl- |
| D、无色溶液:K+、Al3+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:
已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:| A、该温度下此反应平衡常数为3.2 | ||
| B、A的初始物质的量为4 mol | ||
| C、0-15min内,气体密度不变 | ||
D、要使
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-
| ||||
B、将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O
| ||||
| C、Fe2O3固体溶于过量氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | ||||
| D、苯酚钠溶液中通入少量的CO2:2C2H5O-+CO2+H2O→2C2H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾、漂白粉、臭氧的净水原理相同 |
| B、“血液透析”的原理利用了胶体的性质 |
| C、食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 |
| D、煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,Br2+H2?2HBr K=5.6×107 I2+H2?2HI K=43 |
非金属性:Br>I |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com