
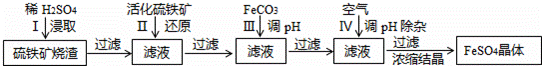
分析 硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体.
(1)H2SO4与Fe2O3反应生成硫酸铁与水;
(2)用KSCN 溶液检验第Ⅱ步中Fe3+是否完全还原;
(3)氧气可以讲亚铁离子氧化为铁离子,铁离子水解使溶液pH降低;
(4)发生反应:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式;
(5)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-;
(6)第Ⅲ步应加入FeCO3后,浸取时加入的硫酸、活化硫铁矿还原Fe3+时生成的硫酸完全转化为FeSO4,根据FeS2~7Fe2(S04)3~7Fe2O3计算参加反应的FeS2的物质的量,根据硫元素守恒计算n总(FeSO4),由Fe元素守恒计算n(FeCO3),再根据m=nM计算其质量.
解答 解:硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体.
(1)H2SO4与Fe2O3反应生成硫酸铁与水,反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)KMnO4溶液、K3[Fe(CN)6]溶液可以检验有Fe2+生成,取第Ⅱ步反应中溶液少许与试管中,滴加KSCN 溶液,若溶液不变红色,说明Fe3+完全被还原,
故答案为:C;
(3)氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+,使溶液pH降低,
故答案为:氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+;
(4)发生反应:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
(5)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-,
故答案为:FeS2+4e-=Fe+2S2-;
(6)Fe2O3含量为50%,ckg烧渣中,Fe2O3质量为50%×ckg,铁的浸取率为96%,侧参加反应的Fe2O3质量为50%×ckg×96%,其物质的量为(50%×c×103×96%)g÷160g/mol=3c mol,
akg质量分数为b%的硫酸中m(H2SO4)=b%×akg,其物质的量为(b%×a×103)g÷98g/mol=$\frac{10ab}{98}$mol,
第Ⅲ步应加入FeCO3后,浸取时加入的硫酸、活化硫铁矿还原Fe3+时生成的硫酸完全转化为FeSO4,
根据FeS2~7Fe2(S04)3~7Fe2O3,可知参加反应的FeS2的物质的量$\frac{1}{7}$×3c mol,
根据硫元素守恒计算n总(FeSO4)=$\frac{1}{7}$×3c mol×2+$\frac{10ab}{98}$mol,
由Fe元素守恒n(FeCO3)=n总(FeSO4)-n(FeS2)-2n(Fe2O3)=$\frac{1}{7}$×3c mol×2+$\frac{10ab}{98}$mol-$\frac{1}{7}$×3c mol-2×3c mol=$\frac{10ab}{98}$mol-$\frac{39c}{7}$mol,故m(FeCO3)=($\frac{10ab}{98}$-$\frac{39c}{7}$) mol×116g/mol≈(11.8ab-646c)g,即为(0.0118ab-0.646c)Kg,
故答案为:(0.0118ab-0.646c).
点评 本题以化学工艺流程为载体,考查离子方程式书写、离子检验、热化学方程式书写、电极反应式、化学计算等,需要学生熟练掌握元素化合物知识,(6)中计算为易错点、难点,注意利用守恒法计算,避免计算繁琐,较好的考查学生分析计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)
X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
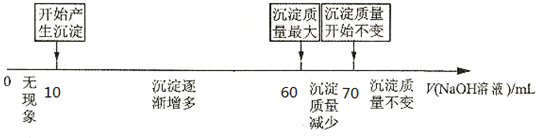
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶于水只发生扩散作用 | |
| B. | 氢氧化钠溶于水只发生水合作用 | |
| C. | 氢氧化钠溶于水扩散过程吸收热量大于水合过程放出的热量 | |
| D. | 氢氧化钠溶于水扩散过程吸收热量小于水合过程放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| B. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| C. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1②2H2(g)+O2(g)=2H2O(1)△H2,则△H1<△2 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1 则C(s,石墨)=C(s,金刚石)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加入等体积0.3mol•L-1NaOH溶液 | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉至蓝色刚好消失后过滤 | |
| C. | 配制1mol/LMgSO4溶液:将12.0gMgSO4固体倒进100mL容量瓶中,然后加入100mL蒸馏水 | |
| D. | 确定Na2CO3溶液中是否混有NaOH:取少量溶液滴加过量BaCl2溶液,过滤取滤液,在滤液中滴加酚酞,观察是否出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com