
【题目】已知某非金属元素X的氢化物化学式为H2X,则其最高价氧化物对应水化物的化学式是
A. HXO4B. H2XO4C. HXO3D. H2XO3
科目:高中化学 来源: 题型:
【题目】下列有关合金的说法正确的是( )
A.组成合金的元素必须是两种或两种以上的金属
B.铝热剂是铝合金
C.将镁粉和铝粉混合即得镁铝合金
D.合金也具有金属的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物.
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N﹣H键断裂,则形成的π键有mol,N2H4的沸点比C2H6的主要原因是 .
(2)F2和过量NH3在铜催化作用下反应生成NF3 , NF3分子的空间构型为 .
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图.写出该反应的化学方程式: . 
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是(填序号).
a.常温下,N2很稳定,是因为N的电离能大
b.钠晶胞结构见图2,每个晶胞含有5个钠原子
c.第一电离能(I1):N>O>P>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有(填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯( ![]() )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯.其合成路线如下:
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯.其合成路线如下: 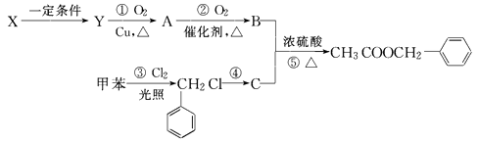
据此回答下列问题:
(1)反应①由Y生成A的化学方程式为 生成物A中含有官能团的名称为 .
(2)实验室为鉴别A和B两者的水溶液,可以选用的化学试剂是 . A.纯碱溶液 B.NaOH溶液 C.金属钠 D.银氨溶液
(3)请写出反应⑤的化学方程式 .
(4)写出符合下列条件的乙酸苯甲酯的一种同分异构体: ①含苯环结构;②具有酯的结构 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.只有热塑性高分子材料才可能是塑料
B.用于包装食品的塑料通常是聚乙烯
C.有机玻璃是一种透光性好的塑料制品
D.脲醛塑料绝缘性好可用作电工器材
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aXn-和bYm+为两主族元素的离子,它们的电子层结构相同,下列判断错误的是( )
A. 原子半径X<Y B. 离子半径Xn-<Ym+
C. a+n=b-m D. X的氢化物的化学式为HnX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗名“大苏打”,又称“海波”.已知Na2S2O35H2O是无色透明晶体,易溶于水,不溶于乙醇.它受热、遇酸易分解,在空气中易被氧化.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O35H2O).反应原理为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2 . 
(1)(图1)制备Na2S2O3
①仪器b的名称 , d中盛放的试剂是 .
②b中制备SO2 , 反应的化学方程式 .
③反应开始后,要控制SO2生成速率,可以采取的措施有(写出一条即可).
(2)分离Na2S2O3并测定含量(图2)
(I)为了减少产品损失,操作①时需 . 操作②是过滤、洗涤、干燥,其中洗涤操作时用做洗涤剂.干燥操作时(装置如图3所示),通入H2的目的是 .
(II)制得的粗晶体中往往含有少量杂质.为了测定粗产品中Na2S2O35H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应).称取1.50g粗产品溶于水,用0.20molL﹣1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中S2O32﹣全部被氧化时,消耗高锰酸钾溶液体积40.00mL.(5S2O32﹣+8MnO4﹣+14H+═8Mn2++10SO42﹣+7H2O)
①KMnO4溶液置于(填“酸式”或“碱式”)滴定管中.
②若 , 则达到滴定终点.
③产品中Na2S2O35H2O的质量分数为(保留小数点后一位).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com