
鉴别苯酚溶液、己烷、己烯、乙酸溶液和乙醇5种无色液体,可选用的最佳试剂组合是( )
A.酸性KMnO4溶液、新制的Cu(OH)2悬浊液
B.FeCl3溶液、金属钠、溴水、石蕊试液
C.石蕊试液、溴水 D.酸性KMnO4溶液、石蕊试液
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
某炔烃经催化加氢后,得到2-甲基丁烷,该炔烃是( )
A.2-甲基-1-丁炔 B.2-甲基-3-丁炔 C.3-甲基-1-丁炔 D.3-甲基-2-丁炔
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如右下图所示,下列说法一定正确的是
A.最高价氧化物对应水化物的酸性最强的是W
B.Y与Z只能形成一种化合物
C.简单阴离子还原性:Y>W
D.Z与Q形成的化合物水溶液可能显酸性

查看答案和解析>>
科目:高中化学 来源: 题型:
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) 。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是(用离子方程式表示) 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol•L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕,
 (4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如右图所示。根据图中信息得出的结论是 。
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如右图所示。根据图中信息得出的结论是 。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是___________ 。
(6)从沉锰工序中得到纯净MnCO3的操作方法是
,沉锰工序中怎样证明MnCO3已经洗涤干净
,副产品A的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯佐卡因是一种局部麻醉剂,可用于黏膜溃疡、创面等的镇痛,一般制成软膏或栓剂使用,它的工业合成有如下所示的两种途径。途径Ⅰ已被逐渐淘汰,现在使用较多的是途径Ⅱ。
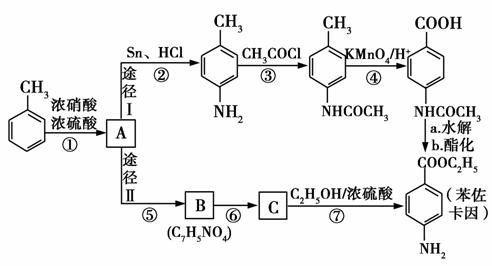
已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
②苯胺( )分子中的氨基易被氧化。
)分子中的氨基易被氧化。
请回答下列问题:
(1)反应①的反应类型为________,化合物B的结构简式为________。
(2)反应⑦的化学方程式为_________________________。
(3)下列关于上述合成路线的说法正确的是________。
a.反应①除了主要生成A物质外,还可能生成 等;
等;
b.途径Ⅱ中的步骤①和⑤可以互换;
c.反应③的另一产的是H2O;
d.与途径Ⅱ相比,途径Ⅰ的缺点是步骤多,产率低;
e.途径Ⅰ中的步骤③的目的是保护氨基不被步骤④中的KMnO4酸性溶液氧化。
(4)途径Ⅱ中的步骤⑤和⑥能互换吗?________,理由是
___________________________________________________。
(5)苯佐卡因有多种同分异构体,其中有2个对位取代基,—NH2直接连在苯环上,分子结构中含有酯基的同分异构体有: 、
、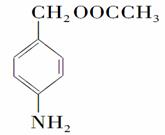 、________、________。
、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如
下反应:3A(g)+B(g) 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1) 在2 min末时,B的平衡浓度为____________,A的平均反应速率为_____________。
(2) 若温度不变,缩小容器容积,则平衡__________________ (填“向正反应方向移动”、“ 向逆反应方向移动”或“不移动”)。
(3) 能判断该反应是否达到化学平衡状态的依据是____________
A.容器中压强不变
B.混合气体中c(C)不变
C.υ生成(D)=υ消耗(D)
D.2c(B)=c(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中不正确的是 ( )

A.光伏发电是将太阳能转变为电能
B.上图中N区半导体为负极,P区半导体为正极,电流从a流向b
C.YAG中钇显+3价
D.Ga与N在元素周期表中不处于同一主族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com