
分析 等体积的0.2mol•L-1CH3COOH和0.2mol•L-1CH3COONa混合后,得浓度均为0.1mol/L的CH3COOH和CH3COONa混合液.在常温下,醋酸的电离平衡常数Ka=1.75×10-5=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,而在浓度均为0.1mol/L的CH3COOH和CH3COONa的混合液中,CH3COOH的电离和CH3COONa的水解相互抑制,据此分析.
解答 解:等体积的0.2mol•L-1CH3COOH和0.2mol•L-1NaAc混合后,得浓度均为0.1mol/L的CH3COOH和CH3COONa的混合液.在常温下,醋酸的电离平衡常数Ka=1.75×10-5=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,而在浓度均为0.1mol/L的CH3COOH和CH3COONa的混合液中,CH3COOH的电离和CH3COONa的水解相互抑制,故CH3COOH的电离和CH3COONa的水解均忽略不计,即溶液中的c(CH3COOH)和c(CH3COO-)均为0.1mol/L,则有:醋酸的电离平衡常数Ka=1.75×10-5=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{c({H}^{+})×0.1mol/L}{0.1mol/L}$,故c(H+)=1.75×10-5mol/L,则溶液的pH=5-lg1.75=5-0.24=4.76,
故答案为:4.76.
点评 本题考查了混合溶液中的pH的有关计算,难度不大,应注意的是酸的电离和对应盐的水解相互抑制,故酸的电离和盐的水解均可忽略不计.


科目:高中化学 来源: 题型:解答题
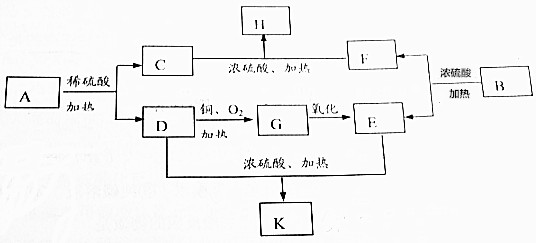
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
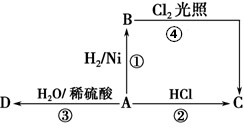
 ;D的结构简式为CH3CH2OH.
;D的结构简式为CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧煤炭供热 | B. | 利用风力发电 | C. | 增加植被面积 | D. | 节约用电用水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱可除去炊具上的油污 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2FeO4是新型水处理剂,其原理与明矾相同 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

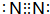 ;⑨的过氧化物
;⑨的过氧化物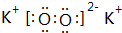 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
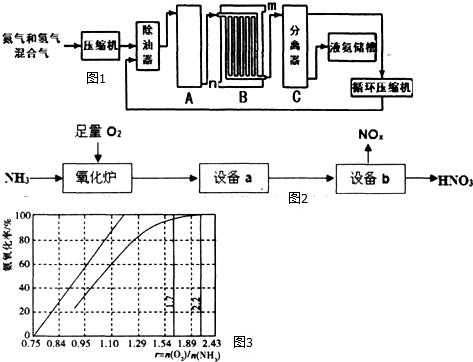
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com