
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通人过量CO2制Al(OH)3:AlO2-+CO2+H2O═Al(OH)3↓+HCO3- | |
| D. | 向含2molAlCl3的溶液中加入1L 7mol/L的NaOH溶液:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |
分析 A.漂白粉溶液在空气中失效是因为次氯酸酸性比碳酸弱,次氯酸钙溶液中吸收二氧化碳反应生成碳酸钙和次氯酸;
B.离子方程式两边总电荷不相等,违反了电荷守恒;
C.离子方程式两边H、O原子不相等,违反了质量守恒;
D.根据n=cV计算出氢氧化钠的物质的量,2mol氯化铝消耗6mol氢氧化钠生成2mol氢氧化铝,剩余的氢氧化钠与氢氧化铝按照1:1反应生成偏铝酸钠,据此写出反应的离子方程式.
解答 解:A.次氯酸钙溶液中吸收二氧化碳反应生成碳酸钙和次氯酸,次氯酸见光分解失效,反应的离子方程式为:2ClO-+CO2+H2O+Ca2+═2HClO+CaCO3↓,故A错误;
B.用浓盐酸与MnO2加热反应生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故B错误;
C.向NaAlO2溶液中通人过量CO2制Al(OH)3,正确的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C错误;
D.向含2molAlCl3的溶液中加入1L 7mol/L(7mol)的NaOH溶液,2mol氯化铝消耗6mol氢氧化钠生成2mol氢氧化铝沉淀,剩余的1molNaOH能够溶解1mol氢氧化铝,反应的离子方程式为:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 可燃物在燃烧时所显示的火焰颜色 | |
| B. | 所有元素在灼烧时都有焰色反应 | |
| C. | 多种金属或它们的化合物灼烧时所显示的火焰颜色 | |
| D. | 焰色反应是一种化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
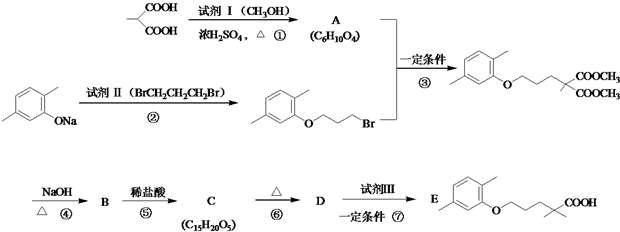
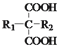 $\stackrel{△}{→}$
$\stackrel{△}{→}$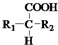 +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基) $\stackrel{△}{→}$
$\stackrel{△}{→}$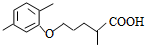 +CO2↑.
+CO2↑.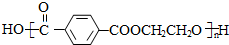 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| C | D | E | |||||
| F | G | H | I | J | K |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
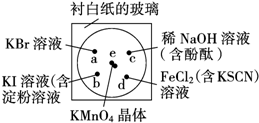 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求,某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L 的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
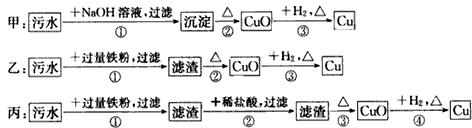
| A. | 三种实验方案中都能制得纯净铜 | |
| B. | 甲方案中的反应涉及置换、分解、复分解三种反应类型 | |
| C. | 乙方案中加过量铁粉只能还原其中的二种阳离子 | |
| D. | 丙方案不会产生环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
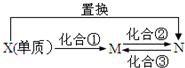 M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )
M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )| A. | X可以是Mg或Cu元素 | |
| B. | 化合②③的反应可以是非氧化还原反应 | |
| C. | 若X为C元素,则该转化关系中X单质发生的置换反应可以是2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| D. | 若X为Fe元素,则M的H218O溶液中加入固体Na2O2的反应为:4Fe3++6H218O+6Na2O2═4Fe(OH)3↓+12Na++318O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com