
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 25℃时,在 c(H+)=$\sqrt{{K}_{W}}$的溶液中,大量存在Na+、S2-、NO3-、CO32-等离子 | |
| C. | 常温,0.1mol•L-1的NaHSO3溶液的pH=6,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
分析 A、蒸馏水中滴加浓H2SO4后温度升高;
B、c(H+)=$\sqrt{{K}_{W}}$的溶液即为pH=7的溶液;
C、0.1mol•L-1的NaHSO3溶液的pH=6,说明HSO3-的电离程度大于其水解程度;
D、NaCl溶液中Na+、Cl-对水的电离没有影响,醋酸铵溶液中CH3COO-、NH4+均促进水的电离.
解答 解:A、蒸馏水中滴加浓H2SO4后温度升高,KW变大,故A错误;
B、c(H+)=的溶液即为pH=7的溶液,S2-、CO32-离子水解显碱性,则不能大量存在,故B错误;
C、0.1mol•L-1的NaHSO3溶液的pH=6,说明HSO3-的电离程度大于其水解程度,故电离产生的离子浓度大于水解产生的离子浓度,水的电离生成氢离子,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故C正确;
D、NaCl溶液中Na+、Cl-对水的电离没有影响,醋酸铵溶液中CH3COO-、NH4+均促进水的电离,故D错误;
故选C.
点评 本题考查了影响水的离子积常数的因素、离子共存、影响水的电离平衡的因素,题目难度不大.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:填空题
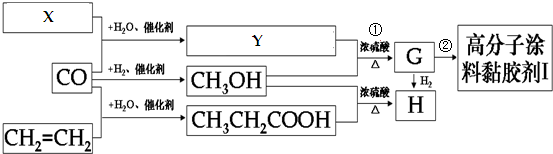
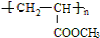
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )| A. | a为负极,电极反应式为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| B. | 反应过程中产生的质子透过阳离子交换膜扩散到好氧区 | |
| C. | 装置中的离子交换膜是阳离子交换膜 | |
| D. | 该装置把电能转化为生物质能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| B. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
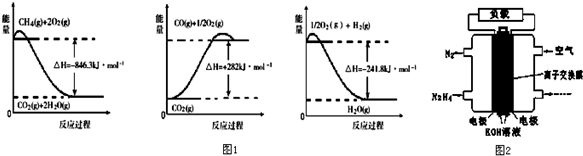
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入CH3COOH溶液后溶液显碱性:c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1的HF溶液与KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)如图为1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=134KJ/mol,E2=368KJ/mol( E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1、△H的变化分别是减小、不变(填“增大”、“减小”或“不变”).写出该反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(1)如图为1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=134KJ/mol,E2=368KJ/mol( E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1、△H的变化分别是减小、不变(填“增大”、“减小”或“不变”).写出该反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com