
在有固体Al(OH)3存在的饱和溶液中,存在有如下平衡:H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-,其他条件不变时,分别加入①盐酸溶液;②NaOH溶液;③水;④分别用NaOH溶液和Hg(NO3)2溶液处理过的铝条,根据平衡原理回答:
Al3++3OH-,其他条件不变时,分别加入①盐酸溶液;②NaOH溶液;③水;④分别用NaOH溶液和Hg(NO3)2溶液处理过的铝条,根据平衡原理回答:
(1)使固体Al(OH)3质量增加的是________,
(2)使![]() 的物质的量增加的是________.
的物质的量增加的是________.
(3)使Al3+的物质的量增加的是________.
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
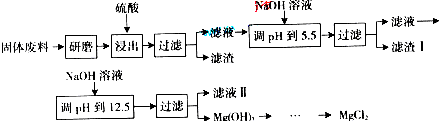
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. | 试管中仍有固体物质 | 固体为 |
| ②操作①后,过滤;在滤液中加入过量的 |
有红褐色沉淀产生 | 沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. | 生成物为Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
H++![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-其他条件不变,分别加入①NaOH溶液;②盐酸;③已分别用NaOH和Hg(NO3)2溶液处理过的铝条;④水。能使Al3+的物质的量增加的是( )
Al3++3OH-其他条件不变,分别加入①NaOH溶液;②盐酸;③已分别用NaOH和Hg(NO3)2溶液处理过的铝条;④水。能使Al3+的物质的量增加的是( )
A.只有② B.①③④ C.②④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cr、OH-、HCO![]() 、NO
、NO![]() 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
(1)该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有 ,
一定不会含有大量的 。
(2)该溶液与Al2O3反应后有【Al(OH)4】生成,则原溶液中一定含有 ,可能含有
大量的 。
(3)写出该溶液与Al2O3反应生成【Al(OH)4】的离子方程式 。
Ⅱ. 研究性学习小组的同学为了了解Cu及其化合物的性质,提出以下问题;
①Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②Fe的+2价化合物的稳定性比+3价化合物的稳定性小,Cu的+l价化合物的稳定性也比+2价化合物的稳定性小吗?
③CuO能被H2、CO等还原,也能被NH3还原吗?
(1)解决问题①需要用到的药品有CuSO4溶液、 (填字母)。
A.AlCl3溶液 B.NaOH溶液 C.稀H2SO4 D.H2O2溶液
假若Cu(OH)2具有两性,应该看到的实验现象是
。
(2)为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2固体,加热至800℃~1000℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变成红色粉末X。冷却后称量,X的质量为72g。向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,X的化学式为 ,可以得出的结论是
。
(3)为解决问题③,设计了如下的实验装置(夹持及尾气处理装置未画出):
在实验中观察到CuO变成红色物质,无水CuSO4变成蓝色,生成物中还有一种无污染的单质气体。装置A的作用是 ,B中发生反应的化学方
程式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com