
【题目】铜的两种氧化物在化工生产中都有着重要的用途。
I.CuO可用于制备Cu2O。
已知:①2Cu2O(s)![]() 4Cu(s)+O2(g) △H1=+338kJ·mol-1;
4Cu(s)+O2(g) △H1=+338kJ·mol-1;
②2CuO(s)![]() 2Cu(s)+O2(g) △H2=+314kJ·mol-1。
2Cu(s)+O2(g) △H2=+314kJ·mol-1。
(1)CuO分解生成2molCu2O的热化学方程式为___。
(2)温度为T时,向5L恒容密闭容器中加入80gCuO制备Cu2O,5min时恰好达到平衡,测得容器中Cu2O的物质的量为0.4mol。
①该反应的平衡常数K=___。
②5min时缩小容器容积,重新达到平衡时O2的浓度___(填“增大”、“减小”或“不变”)。
(3)研究表明,在CuO中加入适量碳粉有利于制得纳米级Cu2O,下列说法正确的是___(填选项字母)。
A.碳与氧气反应放热,加快反应速率 B.生成CO气体,使固体颗粒容易分散
C.CO可以将Cu2O还原为铜粉 D.CO作该反应的催化剂
Ⅱ.CuO可用于冶炼铜(已知:CO的燃烧热△H=—283kJ·mol-1);一定条件下,将1molCuO和0.5molCO加入2L密闭容器中发生反应,t1时达到平衡,t2后改变容器中的条件,用CO表示的反应速率(v)与时间(t)的关系如图所示(三个阶段改变的条件为温度、压强、浓度中的一个)。
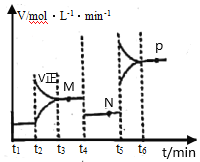
(4)t4时改变的条件为___。
(5)M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为___。
【答案】4CuO(s) ![]() 2Cu2O(s)+O2(g) △H=+314 kJ/mol×2-338 kJ/mol= +290kJ/mol 0.04mol/L 不变 AB 增加CO浓度、增大容器容积(或减小压强)、升高温度 a(M)=a(N)>a(P)
2Cu2O(s)+O2(g) △H=+314 kJ/mol×2-338 kJ/mol= +290kJ/mol 0.04mol/L 不变 AB 增加CO浓度、增大容器容积(或减小压强)、升高温度 a(M)=a(N)>a(P)
【解析】
(1)根据盖斯定律②×2-①得4CuO(s) ![]() 2Cu2O(s)+O2(g) ;
2Cu2O(s)+O2(g) ;
(2)①由信息,达到平衡时, K=c(O2);
②由于平衡常数只与温度有关,根据K=c(O2)得,缩小容器容积,平衡常数不变,重新达到平衡时O2的浓度不变;
(3)碳与氧气反应放热,升高温度,反应速率加快,A项正确;气体生成容品使固体分散,有利于制得纳米级Cu2O,B项正确;CO将Cu2O还原为铜粉降低Cu2O的产率,C项错误;CO不是该反应的催化剂,D项错误;
Ⅱ.(4)由图中信息,t1、t2、t3时改变的条件分别为增加CO浓度、增大容器容积(或减小压强)、升高温度;
(5)t2时,增加CO浓度,但该反应为气体分总数相等的反应,平衡时CO的转化率不变;t4时增大容器容积(或减小压强),平衡不移动,平衡时CO的转化率不变;由反应2CuO(s)=2Cu(s)+O2(g) △H=+314kJ·mol-1和2CO(g)+O2(g)=2CO2(g) △H=-565kJ·mol-1 得CuO(s)+CO(g)Cu(s)+CO2(g) △H=-126 kJ·mol-1,该反应放热,故t3时升高温度,平衡逆向移动,平衡时CO的转化率减小,由此可以求得大小关系。
(1)根据盖斯定律②×2-①得4CuO(s) ![]() 2Cu2O(s)+O2(g) △H=+314 kJ/mol×2-338 kJ/mol= +290kJ/mol;
2Cu2O(s)+O2(g) △H=+314 kJ/mol×2-338 kJ/mol= +290kJ/mol;
(2)①由信息,达到平衡时,Cu2O的物质的量为0.4mol,则参加反应的CuO的物质的量为0.8mol,生成O2的物质的量为0.2mol,K=c(O2)=0.2mol/5L=0.04mol/L;②由于平衡常数只与温度有关,根据K=c(O2)得,缩小容器容积,平衡常数不变,重新达到平衡时O2的浓度不变;
(3)碳与氧气反应放热,升高温度,反应速率加快,A项正确;气体生成容品使固体分散,有利于制得纳米级Cu2O,B项正确;CO将Cu2O还原为铜粉降低Cu2O的产率,C项错误;CO不是该反应的催化剂,D项错误;故选AB;
Ⅱ.(4)由图中信息,t1、t2、t3时改变的条件分别为增加CO浓度、增大容器容积(或减小压强)、升高温度;
(5)t2时,增加CO浓度,但该反应为气体分总数相等的反应,平衡时CO的转化率不变;t4时增大容器容积(或减小压强),平衡不移动,平衡时CO的转化率不变;由反应2CuO(s)=2Cu(s)+O2(g) △H=+314kJ·mol-1和2CO(g)+O2(g)=2CO2(g) △H=-565kJ·mol-1 得CuO(s)+CO(g)Cu(s)+CO2(g) △H=-126 kJ·mol-1,该反应放热,故t3时升高温度,平衡逆向移动,平衡时CO的转化率减小,则M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为a(M)=a(N)>a(P)。


科目:高中化学 来源: 题型:
【题目】下列有关溶液中离子存在和转化表述不正确的是
A.常温下水电离出的c(H+)=1×1012 mol/L的溶液中不可能大量存在:Al3+、![]() 、Cl、S2
、Cl、S2
B.加入铝粉能产生H2的溶液中可能大量存在:Na+、Cl-、S2-、![]()
C.过量铁粉与稀HNO3反应:3Fe+8H++2![]()
![]() 3Fe2++2NO↑+4H2O
3Fe2++2NO↑+4H2O
D.向AlCl3溶液中滴入大量氨水:Al3++4NH3·H2O![]()
![]() +4
+4![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为1L的密闭容器中,l molX和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。
Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。
A.c(X)∶c(Y)∶c(Z) = 2∶1∶lB.容器内原子总数不再发生变化
C.X的百分含量不再发生变化D.同一时间内消耗2n mol X的同时生成n mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知取H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
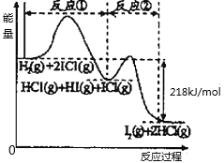
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.H2(g) +2ICl(g)=I2(g)+2HCl(g) △H=-218kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5mol/L、MgCO3的饱和溶液中c(Mg2+)为2.6×10-3mol/L.若在5mL浓度均为0.01mol/L的CaCl2和MgCl2溶液中,逐滴加入5mL 0.012mol/LNa2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A. 25℃时,Ksp(CaCO3)=2.8×10-9
B. 加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C. 滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO3-)>c(OH-)
D. 滤液M中: 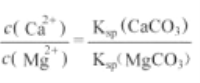
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是

A.2HClO![]() 2HCl+O2↑
2HCl+O2↑
B.NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:
H2(g)+![]() O2(g)
O2(g)![]() H2O(g) △H1
H2O(g) △H1
![]() N2(g)+O2(g)
N2(g)+O2(g)![]() NO2(g) △H2
NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) △H3
NH3(g) △H3
则反应4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的△H为( )
A.△H1+△H2+△H3B.2△H1+2△H2-2△H3
C.6△H1+4△H2+4△H3D.6△H1+4△H2-4△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下几种弱酸或弱碱的电离平衡常数(Ka或Kb)如下表所示:
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HCN | 5×10-10 |
NH3H2O | 1.8×10-5 |
H2SO3 | K1=1.5×10-2,K2=1.1×10-7 |
回答下列问题:
(1)CH3COONH4的水溶液呈中性,其理由是_____________,溶液中各离子浓度大小的关系是___________________。
(2)等物质的量浓度的下列五种溶液:①NH3H2O ②(NH4)2SO3 ③NaHSO3 ④Na2SO3
⑤H2SO3溶液中水的电离程度由大到小的排列顺序为________(填序号)。
(3)向25 mL 0.10 molL-1盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是________(填字母)。
A.c(Cl-)=c(NH4+)>c(H+)=c(OH-) B. c(NH4+)>c(Cl-)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(Cl-)>c(H+) D.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(4)在室温下,0.05 molL-1的NaCN溶液的pH约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是![]()
选项 | 实验操作和现象 | 结论 |
A | 向碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中溶液变浑浊 | 酸性:碳酸 |
B | 向 |
|
C | 向蛋白质溶液中加入甲醛溶液和 | 蛋白质均发生了变性 |
D | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液是钠盐溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com