
| m |
| ρ(铜) |
| 89g |
| 8.9g/cm3 |
| m1 |
| V(空) |
| 156g |
| 20cm3 |
| m |
| ρ(铜) |
| 89g |
| 8.9g/cm3 |
| m1 |
| V(空) |
| 156g |
| 20cm3 |


科目:高中化学 来源: 题型:
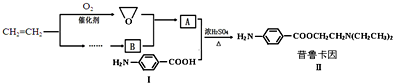
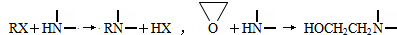
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属离子 | 开始沉演的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 9.6 |
| Co2+ | 5.8 | 9.4 |
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:
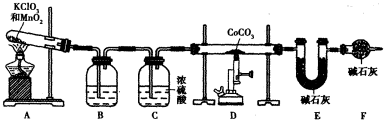
查看答案和解析>>
科目:高中化学 来源: 题型:
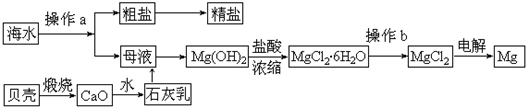
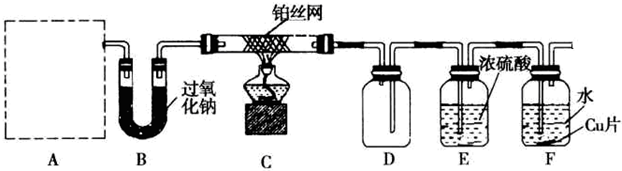
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
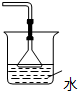 B.
B.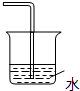 C.
C. D.
D.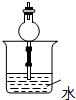
查看答案和解析>>
科目:高中化学 来源: 题型:
A、以下是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有4步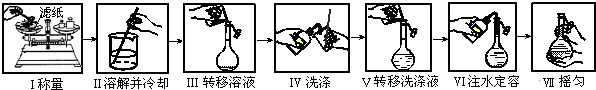 |
| B、苯的硝化实验三种溶液混合过程中,应先在试管中加入浓硝酸,再沿试管壁缓慢加入浓硫酸混合均匀,冷却到50℃以下,再在不断振荡下逐滴加入苯 |
| C、火柴头中硫元素的检测实验中,应用少量1mol?L-1较大浓度的高锰酸钾溶液来吸收SO2气体,以便于观察到褪色的明显实验现象 |
| D、在试管中加入2mL硝酸银溶液,然后加入几滴NaCl溶液,再加入几滴KI溶液,可以观察到白色沉淀变成黄色沉淀,可以说明AgI的KSP小于AgCl的KSP |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com