
| ||
| 0.144(b-a) |
| c |
| ||
| m |
| 14.4(b-a) |
| mc |
| 14.4(b-a) |
| mc |


科目:高中化学 来源: 题型:
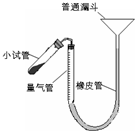
 (2010?梅州一模)过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
(2010?梅州一模)过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:| 14.4(b-a) |
| mc |
| 14.4(b-a) |
| mc |
查看答案和解析>>
科目:高中化学 来源: 题型:
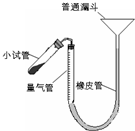
 过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl═CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:| 14.4(b-a) |
| mc |
| 14.4(b-a) |
| mc |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
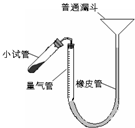
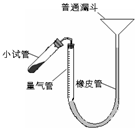 过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HC1═CaCl2+CO2↑+H2O,CaC12+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HC1═CaCl2+CO2↑+H2O,CaC12+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:查看答案和解析>>
科目:高中化学 来源:2010年广东省梅州市高考化学一模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com