
分析 a.同一能级上电子的能量;
b.p轨道的电子云形状为哑铃形;
c.电子云伸展方向在三维方向伸展;
d.电子优先单独占据一个轨道,而且自旋方向相同;
质子数越多,原子核中的正电荷对电子的吸引能力越强,电子里核越近;
(2)Al常温下在浓硫酸中钝化、氯化铝受热易升华、氧化铝硬度大难熔、Al的熔点高于Mg,根据对角线规则知,Be和Al的性质具有相似性,根据Al及其化合物的性质确定Be及其化合物的性质;
(3)BeCl2溶液和Na2BeO2溶液混合生成Be(OH)2沉淀;
(4)将BeCl2溶液加热蒸干后灼热得到氧化铍;
(5)浓度对化学平衡的影响是,增大反应物浓度或减小生成物浓度平衡正向进行,增大生成物浓度或减小反应物浓度,平衡逆向进行;所以反应②对于反应①③来说都是增大反应物浓度和减少生成物的浓度,平衡正向进行提高AlN的产率;
解答 解:a.同一能级上电子的能量,则碳原子2p亚层上的2个电子的能量相同,故a不选;
b.p轨道的电子云形状为哑铃形,则碳原子2p亚层上的2个电子的电子云形状相同,故b不选;
c.碳原子2p亚层上的2个电子的电子云在三维方向伸展,即电子云伸展方向不同,故c选;
d.电子优先单独占据一个轨道,而且自旋方向相同,所以碳原子2p亚层上的2个电子的自旋方向相同,故d不选;
在原子中,质子和中子占的体积都很小,质子数越多,原子核中的正电荷对电子的吸引能力越强,电子里核越近,14N原子与12C原子比,质子数和中子数都更多,核电荷数更大,核对外层电子的引力更大,所以14N原子的原子半径更小;
故答案为:c;在原子中,质子和中子占的体积都很小;电子层数相同时,核电荷数越大,核对外层电子的引力越大,原子半径越小;
(2)Al常温下在浓硫酸中钝化、氯化铝受热易升华、氧化铝硬度大难熔、Al的熔点高于Mg,根据对角线规则知,Be和Al的性质具有相似性,
A.常温下,铍会在浓硫酸中钝化,故A正确;
B.氯化铍固体会发生升华现象,故B正确;
C.氧化铍坚硬难熔,故C正确;
D.铍的熔点高于镁,故D错误;
故答案为:d;
(3)BeCl2溶液和Na2BeO2溶液混合生成Be(OH)2沉淀,其反应的离子方程式为:Be2++BeO22-+2H2O=2Be(OH)2↓;
故答案为:Be2++BeO22-+2H2O=2Be(OH)2↓;
(4)将BeCl2溶液加热时促进铍离子的水解生成Be(OH)2,蒸干后灼热得到氧化铍,电解熔融的BeO得到BE和氧气;
故答案为:O2;
(5)浓度对化学平衡的影响是,增大反应物浓度或减小生成物浓度平衡正向进行,增大生成物浓度或减小反应物浓度,平衡逆向进行,反应②消耗O2会使反应①的平衡右移,使Al(g)浓度增大,反应③的平衡右移,提高AlN的产率,所以反应②对于反应①③来说都是增大反应物浓度,平衡正向进行提高AlN的产率;
故答案为:消耗O2,使①的平衡右移;①的平衡右移又增加了铝蒸气的浓度,使③平衡右移,有利于制备AlN.
点评 本题考查了原子结构和性质、电子排布、元素化合物的性质、化学平衡移动等,题目涉及的知识点较多,难度中等,侧重于考查学生对基础知识的综合应用能力,注意把握原子轨道和电子填充规则.


科目:高中化学 来源: 题型:选择题
| A.用Ca(OH)2和 NH4Cl制取NH3 | B.从碘水中提取碘单质 | C.从食盐水中获取氯化钠 | D.用自来水制取蒸馏水 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4+5H2${\;}_{\;}^{18}$O2+3H2SO4→K2SO4+2MnSO4+5${\;}_{\;}^{18}$O2↑+8H2O | |
| B. | NH4Cl+${\;}_{\;}^{2}$H2O?NH3•${\;}_{\;}^{2}$H2O+HCl | |
| C. | K${\;}_{\;}^{37}$ClO3+6HCl→K${\;}_{\;}^{37}$Cl+3Cl2↑+3H2O | |
| D. | 2Na2O2+2H2${\;}_{\;}^{18}$O→4NaOH+${\;}_{\;}^{18}$O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
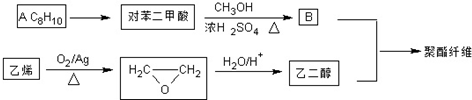
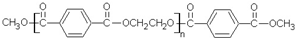 若乙二醇过量,则生成的聚酯纤维可表示为
若乙二醇过量,则生成的聚酯纤维可表示为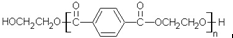 .
.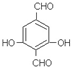 .
.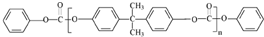 合成PC的2种单体的中:醇(或酚)的结构简式为
合成PC的2种单体的中:醇(或酚)的结构简式为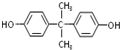 ,酯的名称为碳酸二苯酚酯.
,酯的名称为碳酸二苯酚酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有离子键 | B. | 属于原子晶体 | ||
| C. | 既有离子键又有共价键 | D. | 属于离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
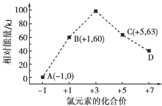 氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 相对分子质量 | 87 | 67.5 | 183 |
| 沸点/℃ | 2 | 9.7 | 81 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 官能团 | 选择试剂 | 实验现象 | 有关反应的化学方程式或离子方程式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com