
| A、中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打用于治疗胃溃疡病人的胃酸过多症 |
| B、工厂常用的静电除尘方法与胶体性质无关 |
| C、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 |
| D、电解从海水中得到的氯化钠溶液可获得金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA |
| B、标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA |
| C、8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA |
| D、1 mol Na被完全氧化生成Na2O2,失去2 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
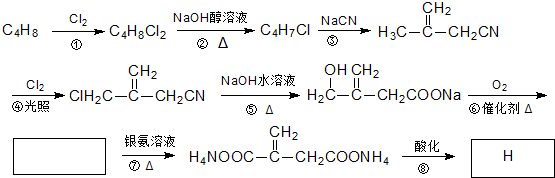
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、样品中Fe元素的质量为1.12 g |
| C、样品中CuO的质量为4.0 g |
| D、V=448 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, | 若有白色沉淀生成,说明产品中含有NaCl. |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1. | 若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应的特征是电子的转移 |
| B、氧化剂在反应中被还原,生成氧化产物 |
| C、同一反应中,氧化剂得电子的总数一定等于还原剂失电子的总数 |
| D、任何反应中一定有氧化剂和还原剂,且氧化剂和还原剂可以为同种物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com