
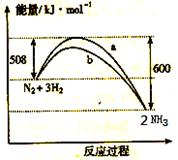
右图是198K 时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
A.该反应的热化学方程式为:
N2 + 3H2  2NH3, △H = -92kJ·mol-1
2NH3, △H = -92kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂, 该化学反应的反应热改变
D.在温度、体积一定的条件下, 通入lmol N2和3molH2 反应后放出的 热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
草酸是中强酸,草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,下列关系正确的是
①c(K+)+c(H+)=c(HC2O )+c(OH-)+c(C2O
)+c(OH-)+c(C2O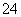 )
)
②c(HC2O )+c(C2O
)+c(C2O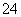 )=0.1 mol·L-1
)=0.1 mol·L-1
③c(C2O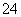 )>c(H2C2O4)
)>c(H2C2O4)
④c(K+)=c(H2C2O4)+c(HC2O )+c(C2O
)+c(C2O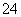 )
)
A.①② B.①④ C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中,正确的是 ( )
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO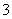 )>c(SO
)>c(SO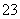 )>c(OH-)
)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式
(i) I2(g)+H2(g) 2HI(g) △H= - 9.48kJ/mol
2HI(g) △H= - 9.48kJ/mol
(ii) I2(s)+H2(g) 2HI(g) △H=+ 26.48kJ/mol
2HI(g) △H=+ 26.48kJ/mol
下列判断正确的是
A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下2HBr(g) H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
H2(g)+Br2(g); △H>0,达到平衡时,要使混合气体颜色加深,可采取的方法
A.升高温度 B.缩小体积 C.减小压强 D. 增大H2浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知在K2Cr2O7的溶液中存在如下平衡: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,观察到的现象为__________;在此基础上再滴加5-10滴6mol/LNaOH溶液,溶液颜色变化为__________。
2CrO42-(黄色)+2H+,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,观察到的现象为__________;在此基础上再滴加5-10滴6mol/LNaOH溶液,溶液颜色变化为__________。
(2)已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是__________(填序号)。
①生成物的产量一定增加 ②生成物的体积分数一定增加
③反应物的浓度一定降低 ④反应物的转化率一定增加
⑤正反应速率一定大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,a g气体A与b g气体B的分子数相同,下列说法中,不正确的是( )
A.A和B的相对分子质量之比为a∶b
B.同温同压下,A与B的密度之比为b∶a
C.同质量的A与B的物质的量之比为b∶a
D.同温同压下,同体积的A与B的质量之比为a∶b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com