
【题目】烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )

A. 曲线a表示Na+的物质的量的变化
B. 曲线c表示Ba2+的物质的量的变化
C. 加入50 mL Ba(OH)2溶液时反应的离子方程式为Ba2++2OH-+2H++ ![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 加入Ba(OH)2溶液体积大于50 mL后,反应的离子方程式为OH-+H+H2O
【答案】C
【解析】100 mL 1 mol/L的NaHSO4溶液中逐滴滴加1 mol/L的Ba(OH)2溶液,Na+的物质的量不变,故A错误;100 mL 1 mol/L的NaHSO4溶液中滴加100 mL 1 mol/L的Ba(OH)2溶液时, ![]() 恰好沉淀完全,溶液中Ba2+的物质的量为0,故B错误;加入50 mL Ba(OH)2溶液时生成水和硫酸钡的物质的量比为2:1,反应的离子方程式为Ba2++2OH-+2H++
恰好沉淀完全,溶液中Ba2+的物质的量为0,故B错误;加入50 mL Ba(OH)2溶液时生成水和硫酸钡的物质的量比为2:1,反应的离子方程式为Ba2++2OH-+2H++ ![]() BaSO4↓+2H2O,故C正确;加入Ba(OH)2溶液体积等于50 mL时,溶液中的溶质是硫酸钠,再加入Ba(OH)2溶液,反应的离子方程式为Ba2++
BaSO4↓+2H2O,故C正确;加入Ba(OH)2溶液体积等于50 mL时,溶液中的溶质是硫酸钠,再加入Ba(OH)2溶液,反应的离子方程式为Ba2++ ![]() BaSO4↓,故D错误。
BaSO4↓,故D错误。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在任何条件下,纯水显中性,这是因为 ( )
A、PH=7 B、c(H+)=c(OH-)
C、c(H+)=c(OH-)=10-7mol/L D、c(H+)×c(OH-)=10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,质量为95 g的氯化镁溶解在0.2 L水中(水的密度近似为1 g/mL)恰好得到氯化镁的饱和溶液,所得溶液的密度为ρ g/mL,物质的量浓度为c mol/L,溶解度为s,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( )
A. 所得溶液中含有NA个氯化镁分子
B. 所得溶液的物质的量浓度为5 mol/L
C. 所得溶液的溶解度可表示为9500 c/(1000ρ-95c)
D. 所得溶液的质量分数可表示为95 ρ/(1000c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【合肥市2017届第三次模拟考试】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ.CO还原法
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______(填“放出”或“吸收”)的热量为_________。
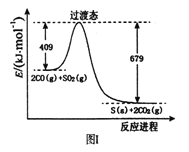
(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)![]() S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
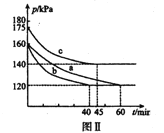
Ⅱ.Na2SO3溶液吸收法
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
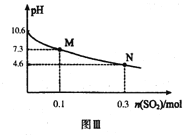
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A.NH3·H2O B.Na2S C.Na2CO3 D.FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烃的命名正确的是( )
A.3,3,5-三甲基-4-乙基已烷B.3,5,5-三甲基庚烷
C.3,3-二甲基-4-异丙基已烷D.2,2,3-三甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡水中学2017届第二次模拟】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
sabatior反应:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
(1)将原料气按nCO2∶nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
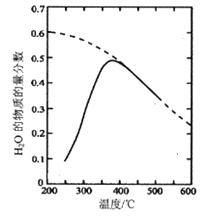
①己知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。计算Sabatier反应的△H=___kJ/mol。
②温度过高或过低均不利于该反应的进行,原因是________。
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
在250℃,向体积为2L且带气压计的恒容密闭容器中通入0.08molH2和0.04molCO2发生Bosch 反应CO2(g)+2H2(g)![]() C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H
①若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图I 曲线a所示,则△H___ 0(填“>”“<”或“不确定”) ;若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I 曲线b所示,则改变的条件是______________。
②图II是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____________(填“甲”或“乙”):m值为____________。

③Bosch反应必须在高温下才能启动,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届株洲市上学期教学质检】甲、乙、丙、X是中学化学中常见的4种物质,其转化关系如图,其中甲和X不可能是

A.甲为C2H5OH、X为O2 B.甲为H2S、X为O2
C.甲为HNO3 、X为Fe D.甲为AlCl 3 溶液、X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2+是一种非常好的还原剂,能够与很多氧化剂发生反应。
(1)在加热条件下,FeSO4可与硫酸酸化的KNO3反应,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NO气体。
①请写出该化学反应方程式,并用单线桥表示出电子转移的方向和数目_________________。
②上述反应发生还原反应的物质是______________ 。
③若11.4gFeSO4参与反应,则产生NO气体的体积(标况下)___________L。
(2)难溶物FeS能够与硫酸酸化的KMnO4溶液反应,反应方程式如下:
10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+l0 +24H2O
①横线上的物质的化学式是___________。
②该反应的氧化产物是______________。
③若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生转移的电子数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com