
分析 (1)同种元素形成的不同单质互为同素异形体;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团的化合物,官能团数目和种类相等;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团的化合物,官能团数目和种类相等;
具有相同分子式而结构不同的化合物互为同分异构体;
(2)烷烃命名中遵循长、多、近、小、简原则,据此书写结构简式即可;
(3)依据烷烃命名原则命名即可.
解答 解:(1)①金刚石和C60 为碳元素形成的不同种单质,互为同素异形体;
②H、D和T为氢元素的不同种原子,互为同位素;
③乙烷和已烷分子结构类似,分子组成上相差4个CH2原子团,属于同系物;
④CH3(CH2)2CH3和(CH3)2CHCH3分子式相同,结构不同,属于同分异构体,
故答案为:②、①、③、④;
(2)2,2-二甲基-丁烷,主链4个C原子,2号碳原子有两个甲基,结构简式:CH3C(CH3)2CH2CH3,故答案为:CH3C(CH3)2CH2CH3;
(3)CH3CH(C2H5)CH(CH3)2,为烷烃,最长碳链为5,在2、3号碳上分别含有1个甲基,根据烷烃的命名方法,该有机物的名称为:CH3CH(C2H5)CH(CH3)2,故答案为:2,3-二甲基戊烷.
点评 本题主要考查了同系物、同分异构体、同位素、同素异形体、同一物质的区别以及烷烃的命名,题目难度不大,注意掌握“五同”的概念及区别,把握其概念的内涵与外延.


科目:高中化学 来源: 题型:解答题
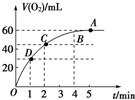 将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.
将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加压有利于化学平衡向正反应方向移动 | |
| B. | 该反应的化学平衡常数表达式为:K=$\frac{{c}^{2}{N}_{2}{H}_{4}×{c}^{2}N{O}_{2}}{{c}^{3}{N}_{2}×{c}^{4}{H}_{2}O}$ | |
| C. | 升高温度可缩短反应达平衡的时间但不能提高平衡转化率 | |
| D. | 使用催化剂可缩短反应达平衡的时间但不能提高平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的N2与O2中的所含分子数均为NA | |
| B. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| C. | 常温常压下,22gCO2含有的原子数为1.5NA | |
| D. | 1mol/L NaOH溶液中含有的Na+的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:
Ⅰ已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如表:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.33 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 | |
| B. | 60g SiO2中含硅氧键数目为4NA | |
| C. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 3.9gNa2O2中所含的阴离子数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com