
| 实验所用试剂或操作 | 实 验 现 象 | 验证的性质 |
| 碘化钾淀粉溶液 | ||
| 取适量过氧化氢溶液于试管中,加热,用带火星的木条检验. |
分析 Ⅰ.(1)验证双氧水的氧化性,可以加入具有还原性的物质,双氧水能使淀粉碘化钾溶液变蓝色,有明显现象证明,如果将双氧水加热产生能使带火星的木条复燃的物质,则证明双氧水不稳定;
(2)2Fe2++H2O2+2H+=2Fe3++2H2O中Fe元素的化合价升高,O元素的化合价降低;2Fe3++H2O2=2Fe2++O2↑+2H+中Fe元素的化合价降低,O元素的化合价升高,总反应为2H2O2═2H2O+O2↑,以此来解答.
Ⅱ.(1)根据准确配制一定体积一定物质的量浓的溶液用到的仪器来回答;
(2)残缺方程式配平首先确定缺什么,根据电子转移守恒,配平化学方程式;
(3)酸式滴定管可以量取具有强氧化性的溶液,高锰酸钾具有颜色,锰离子无色;
(4)根据化学方程式计算消耗过氧化氢的量然后计算质量分数;
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则有一部分溶液占据了气泡的体积.
解答 解:Ⅰ.(1)如果双氧水能使淀粉碘化钾溶液变蓝色,则说明双氧水氧化碘离子生成碘单质,碘遇淀粉变蓝色,所以能证明双氧水有氧化性;
如果将双氧水加热产生能使带火星的木条复燃的物质,则说明双氧水分解生成氧气,所以能证明双氧水不稳定,
| 实验所用试剂或操作 | 实 验 现 象 | 验证的性质 |
| 碘化钾淀粉溶液 | 溶液变蓝色 | 验证氧化性 |
| 取适量过氧化氢溶液于试管中,加热,用带火星的木条检验. | 带火星的木条复燃 | 验证不稳定性 |
| 实 验 现 象 | 验证的性质 | |
| 溶液变蓝色 | 验证氧化性 | |
| 带火星的木条复燃 | 验证不稳定性 |
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意总反应及催化剂的判断,题目难度中等.


科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
有一块铁的“氧化物”样品,用140 mL 5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
向下图装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液退色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是
A | B | C | D | NO2 | HCl | SO2[来 | |
Y | Na2SO3溶液 | 水 | Na2SO3溶液 | 饱和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
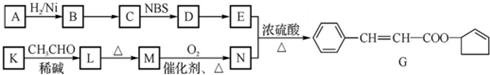
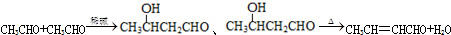
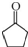
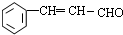 +2Cu(OH)2 $\stackrel{△}{→}$
+2Cu(OH)2 $\stackrel{△}{→}$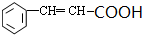 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
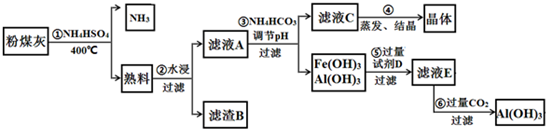
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com