
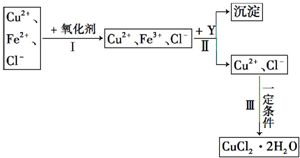
 CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2?2H2O晶体,拟定实验步骤如图所示:请回答下列问题:
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2?2H2O晶体,拟定实验步骤如图所示:请回答下列问题:

科目:高中化学 来源: 题型:
| A、生成物总能量一定低于反应物总能量 |
| B、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C、人类利用的能量都是通过化学反应获得的 |
| D、在化学反应中只有燃烧反应才能放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4分子的球棍模型: | ||
B、Cl-离子的结构示意图: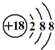 | ||
C、氟化钠的电子式: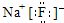 | ||
D、中子数为146、质子数为92 的铀原子
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
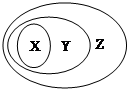
| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 酸、碱、盐 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
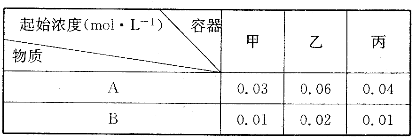
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体硝酸铜受热分解 |
| B、Na2O2与足量的稀硫酸反应 |
| C、木炭和浓硫酸共热 |
| D、足量的铜跟一定量的浓硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com